Quan sát các hình 5.5 và 5.6, cho biết các ion Mg2+ và O2- có lớp vỏ tương tự khí hiếm nào.

Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

- Xét ion Na+:
+ Có 10 hình cầu màu xanh ở các đường tròn => Có 10 electron ở lớp vỏ
+ Có 2 đường tròn xung quanh hạt nhân => Có 2 lớp electron
=> Lớp vỏ ion Na+ tương tự vỏ nguyên tử của nguyên tố khí hiếm Ne
- Xét ion Cl-
+ Có 18 hình cầu màu xanh ở các đường tròn => Có 18 electron ở lớp vỏ
+ Có 3 đường tròn xung quanh hạt nhân => Có 3 lớp electron
=> Lớp vỏ ion Cl- tương tự vỏ nguyên tử của nguyên tố khí hiếm Ar

Trong phân tử hydrogen, nguyên tử H có:
+ 2 quả cầu màu xanh ở đường tròn => Có 2 electron ở lớp vỏ
+ 1 đường tròn xung quanh hạt nhân => Có 1 lớp electron
=> Trong phân tử hydrogen, nguyên tử H có lớp vỏ tương tự khí hiếm He

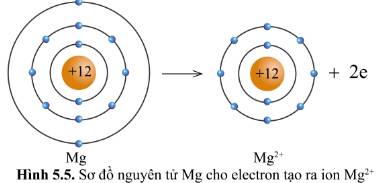
- Nguyên tử Mg có 12 electron và 3 lớp electron
- Ion Mg2+ có 10 electron và 2 lớp electron
=> Nguyên tử Na đã mất đi 2 electron để tạo thành ion Mg2+

- Sự tạo thành ion sodium: Nguyên tử sodium (Na) cho đi 1 electron lớp ngoài cùng để tạo thành ion dương Na+
- Sự tạo thành ion magnesium: Nguyên tử magnesium (Mg) cho đi 2 electron lớp ngoài cùng để tạo thành ion dương Mg2+
=> Sau khi nhường electron, ion sodium và ion magnesium đều có 2 lớp electron và có 8 electron ở lớp ngoài cùng
=> Sự phân bố electron của 2 ion này giống sự phân bố electron của nguyên tử khí hiếm Neon (Ne)

- Sự tạo thành ion chloride: Nguyên tử chlorine (Cl) nhận thêm 1 electron ở lớp ngoài cùng để tạo thành ion âm Cl-
- Sự tạo thành ion oxide: Nguyên tử oxygen (O) nhận thêm 2 electron ở lớp ngoài cùng để tạo thành ion âm O2-
- Sau khi nhận electron, ion chloride có 3 lớp electron và có 8 electron ở lớp ngoài cùng
=> Giống sự phân bố electron của nguyên tử khí hiếm Neon (Ne)
- Sau khi nhận electron, ion oxide có 2 lớp electron và có 8 electron ở lớp ngoài cùng
=> Giống sự phân bố electron của nguyên tử Argon (Ar)

Nguyên tử `O` liên kết với nguyên tử `H` theo cách dùng chung electron, vỏ nguyên tử lớp oxygen giống lớp vỏ của nguyên tử khí hiếm `Ne`.

a)He -> số e ngoài cùng: 2
b)Ne -> số e ngoài cùng: 8
c) Ar-> số e ngoài cùng: 8

1.
- Các electron sắp xếp thành từng lớp theo thứ tự từ trong ra ngoài: Lớp thứ nhất (lớp trong cùng) → Lớp thứ 2 → Lớp thứ 3
2.
- Số electron trên từng lớp ở vỏ nguyên tử chlorine:
+ Lớp thứ nhất có 2 electron
+ Lớp thứ hai có 8 electron
+ Lớp thứ ba có 7 electron

D
Ta thấy các ion N a + , M g 2 + , O 2 - , F ¯ đều có cùng cấu hình electron 1 s 2 2 s 2 2 p 6 .
Các ion cùng electron so sánh điện tích trong nhân, điện tích hạt nhân càng lớn, lực hút electron càng mạnh, bán kính ion càng nhỏ.
Vậy thứ tự giảm dần bán kính là: O 2 - > F ¯ > N a + > M g 2 +
Xét ion Mg2+ : Có 10 electron ở lớp vỏ,có 2 lớp electron
=> Lớp vỏ Mg2+ tương tự vỏ nguyên tử của nguyên tố hiếm Ne
Xét ion O2- : Có 10 electron ở lớp vỏ,có 2 lớp 2lectron
=> Lớp vỏ O2- tương tự vỏ nguyên tử của nguyên tố hiếm Ne