Cho 44,1 (g) H2SO4 phản ứng hoàn toàn với dung dịch CaCl2, sau phản ứng thu được m (g) kết tủa CaSO4. Để trung hòa axit dư 20 (g) NaOH, tính m?
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Đáp án:
m =32,4g
mddH2SO4 = 49g
Giải thích các bước giải:
a) MgCO3 + H2SO4 → MgSO4 + H2O +CO2 ↑
MgSO4 + 2NaOH → Mg(OH)2 + Na2SO4
$Mg{(OH)_2}\buildrel {to} \over
\longrightarrow MgO + {H_2}O$
b) nCO2 = 2,24 : 22,4 = 0,1mol
nMgCO3 = nCO2 = 0,1 mol
nMgO = 12:40=0,3mol
nMgSO4 = nMgO - nMgCO3 = 0,3 - 0,1 = 0,2mol
m = mMgCO3 + mMgSO4
= 0,1 .84+0,2.120=32,4g
nH2SO4 = nCO2 = 0,1 mol
mH2SO4 = 0,1.98=9,8g
mddH2SO4 = 9,8:20.100=49g
chúc bạn học tốt

Đáp án : A
C6H5OH + 3Br2 -> C6H2OH(Br)3 + 3HBr
=> nkết tủa = nphenol = 0,1 mol
nNaOH = nHBr + nCH3COOH => nCH3COOH = 0,1 mol
=> m = 15,4g

Đáp án B
Đốt cháy Y3 trong 0,34 mol O2 và 1,36 mol N2 thì thu được Y4 có CO2, H2O và N2. Có thể có O2 dư
Nhưng Y4 đi qua H2SO4 được hỗn hớp khí đi ra có 2 khí nên Y4 không có oxi
Khối lượng dd H2SO4 tăng là 7,92 g là khối lượng của nước → nH2O = 0,44 mol
Đi qua bình đựng Ca(OH)2 thì CO2 được giữ lại
nCaCO3 = 0,11 mol
mdd tăng= mCO2 – mCaCO3 => mCO2 = 11 + 10,12 =21,12→ nCO2 = 0,48 mol
Bảo toàn nguyên tố O cho phương trình đốt cháy có
nO(Y3) + 2nO2 = 2nCO2 + nH2O → nO(Y3) =2.0,48 + 0,44 – 0,34.2= 0,72 mol
→ O ¯ = 0 , 72 0 , 2 = 3 , 6 → Y2 có không quá 3 nhóm OH vì Y1 có 4 nguyên tử O
C ¯ = 0 , 48 0 , 2 = 2 , 4 và số H =0,44.2 : 0,2 =4,4→ axit có không quá 4H
TH1: axit (COOH)2
Ancol 2 nhóm OH thì số mol axit ancol lần lượt là x, y thì x + y =0,2 và 4x + 2y =0,72
→ x =0,14 mol và y =0,04 mol
→ ancol có 5C và 15H (loại)
Ancol 3 nhóm OH thì x + y =0,2 và 4x + 3y =0,2
→ x =0,12 và y = 0,08 mol→ ancol 3C và 8H loại→ C3H8O3
TH2: CH2(COOH)2→ không thỏa mãn với ancol 2, 3 nhóm OH
→ ancol là C3H8O3
→ Y6 tạo bới C3H8O3 và (COOH)2
→ đốt cháy muối thu được rắn Na2CO3 : 0,24 mol→ NaOH :0,48 mol
→ nY6 = 0,48/(2n) mol → MY6 =109n ( với n là số phân tử axit tạo Y6)
Với n = 1 thì Y6= 109 không có chất thỏa mãn
Với n = 2 thì Y6= 216 hợp chất thỏa mãn

Ta có: $n_{P_2O_5}=\frac{m}{141}(mol);n_{NaOH}=1,014(mol)$
$\Rightarrow n_{H_3PO_4}=\frac{m}{71}\Rightarrow n_{H_2O}=\frac{3m}{71}$
Bảo toàn khối lượng ta có:
\(\dfrac{98}{71}m+40,56=3m+\dfrac{3m}{71}.18\Rightarrow m=17,04\left(g\right)\)
\(n_{NaOH} = 0,507.2 = 1,014(mol)\)
Nếu rắn khan chứa :
\(\left\{{}\begin{matrix}Na^+:1,014\left(mol\right)\\PO_4^{3-}:x\left(mol\right)\\HPO_4^{2-}:y\left(mol\right)\end{matrix}\right.\)
Bảo toàn P : 0,5(x + y).142 = m
Muối : \(m_{muối}\) = 1,014.23 + 95x + 96y = 3m
Bảo toàn điện tích: 3x + 2y = 1,014
Suy ra: y =-0,432 <0 => Loại
\(\left\{{}\begin{matrix}Na^+:1,014\left(mol\right)\\PO_4^{3-}:a\left(mol\right)\\OH^-:b\left(mol\right)\end{matrix}\right.\)
Bảo toàn điện tích : 3a + b = 1,014
\(m_A\) = 1,014.23 + 95a + 17b = 3m
Bảo toàn P : 0,5a.142 = m
Suy ra: a = 0,24 ; b = 0,294; m = 17,04(gam)
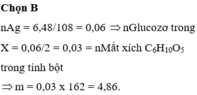
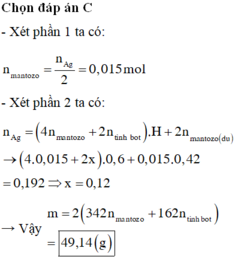
Ta có: \(n_{H_2SO_4}=\dfrac{44,1}{98}=0,45\left(mol\right)\)
\(n_{NaOH}=\dfrac{20}{40}=0,5\left(mol\right)\)
PT: \(H_2SO_4+CaCl_2\rightarrow2HCl+CaSO_{4\downarrow}\)
\(H_2SO_{4\left(dư\right)}+2NaOH\rightarrow Na_2SO_4+2H_2O\)
Theo PT: \(n_{H_2SO_4\left(dư\right)}=\dfrac{1}{2}n_{NaOH}=0,25\left(mol\right)\)
\(\Rightarrow n_{H_2SO_4\left(pư\right)}=0,45-0,25=0,2\left(mol\right)\)
Theo PT: \(n_{CaSO_4}=n_{H_2SO_4\left(pư\right)}=0,2\left(mol\right)\)
\(\Rightarrow m_{CaSO_4}=0,2.136=27,2\left(g\right)\)