cho 4g canxi tác dụng hoàn toàn với 1,68l khí oxi (đktc) thu được canxioxit. nếu lấy lượng canxioxit trên cho vào nước thì thu được bao nhiêu gam canxihidroxit
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


\(a) Fe + 2HCl \to FeCl_2 + H_2\\ n_{H_2} = n_{Fe} = \dfrac{5,6}{56} = 0,1(mol)\\ \Rightarrow V_{H_2} = 0,1.22,4 = 2,24(lít)\\ b) n_{O_2} = \dfrac{6,72}{22,4} = 0,3(mol)\\ 2H_2 + O_2 \xrightarrow{t^o} 2H_2O\\ \dfrac{n_{H_2}}{2} = 0,05 < \dfrac{n_{O_2}}{1} = 0,3 \to O_2\ dư\\ n_{H_2O} = n_{H_2} = 0,1(mol) \Rightarrow m_{H_2O} = 0,1.18 = 1,8(gam)\)

a, \(n_{Ca}=\dfrac{12}{40}=0,3\left(mol\right)\)
PT: \(Ca+2H_2O\rightarrow Ca\left(OH\right)_2+H_2\)
Theo PT: \(n_{H_2}=n_{Ca}=0,3\left(mol\right)\Rightarrow V_{H_2}=0,3.22,4=6,72\left(l\right)\)
b, \(n_{Ca\left(OH\right)_2}=n_{Ca}=0,3\left(mol\right)\Rightarrow m_{Ca\left(OH\right)_2}=0,2.74=22,2\left(g\right)\)
c, \(n_{Fe_3O_4}=\dfrac{8,4}{232}=\dfrac{21}{580}\left(mol\right)\)
PT: \(Fe_3O_4+4H_2\underrightarrow{t^o}3Fe+4H_2O\)
Xét tỉ lệ: \(\dfrac{\dfrac{21}{580}}{1}< \dfrac{0,3}{4}\), ta được H2 dư.
Theo PT: \(n_{Fe}=3n_{Fe_3O_4}=\dfrac{63}{580}\left(mol\right)\Rightarrow m_{cr}=m_{Fe}=\dfrac{63}{580}.56=\dfrac{882}{145}\left(g\right)\)

a/ Ta có: \(n_{KClO_3}=\dfrac{12.25}{122.5}=0.1\left(mol\right)\)
PTHH:
\(2KClO_3\underrightarrow{t^o}2KCl+3O_2\uparrow\)
2 3
0.1 x
\(=>x=\dfrac{0.1\cdot3}{2}=0.15=n_{O_2}\)
\(=>V_{O_2}=0.15\cdot22.4=3.36\left(l\right)\)
PTHH: \(KClO_3\underrightarrow{t^o}KCl+\dfrac{3}{2}O_2\)
a) Ta có: \(n_{KClO_3}=\dfrac{12,25}{122,5}=0,1\left(mol\right)\)
\(\Rightarrow n_{O_2}=0,15\left(mol\right)\) \(\Rightarrow V_{O_2}=0,15\cdot22,4=3,36\left(l\right)\)
b) PTHH: \(3Fe+2O_2\underrightarrow{t^o}Fe_3O_4\)
Ta có: \(n_{Fe}=\dfrac{11,2}{56}=0,2\left(mol\right)\)
Xét tỉ lệ: \(\dfrac{0,2}{3}< \dfrac{0,15}{2}\) \(\Rightarrow\) Oxi còn dư, Fe p/ứ hết
\(\Rightarrow n_{Fe_3O_4}=\dfrac{1}{15}\left(mol\right)\) \(\Rightarrow m_{Fe_3O_4}=\dfrac{1}{15}\cdot232\approx15,47\left(g\right)\)

nca(oh)2=14,8/74=0,2mol
pt(1): 2Ca +O2\(\underrightarrow{t^o}\)2CaO
Pt(2):CaO+H2O\(\underrightarrow{ }\)Ca(OH)2
npứ:0,2 \(\leftarrow\)0,2
theo pt(1) nca=ncao\(\Rightarrow\)nca=ncao=0,2mol
\(\Rightarrow\)mca=0,2.40=8g
2Ca + O2 --to--➢ 2CaO (1)
CaO + H2O → Ca(OH)2 (2)
\(n_{Ca\left(OH\right)_2}=\dfrac{14,8}{74}=0,2\left(mol\right)\)
Theo PT2: \(n_{CaO}=n_{Ca\left(OH\right)_2}=0,2\left(mol\right)\)
\(n_{CaO\left(2\right)}=n_{CaO\left(1\right)}\)
Theo PT1: \(n_{Ca}=n_{CaO}=0,2\left(mol\right)\)
\(\Rightarrow m=m_{Ca}=0,2\times40=8\left(g\right)\)

Em đăng tách câu hỏi ra nhé!
---
Bài 1:
Na2CO3 + CaCl2 -> 2 NaCl + CaCO3
m(kt)=mCaCO3=20(g)
-> nCaCO3=0,2(mol)
-> nNa2CO3=0,2(mol)
=> m= mNa2CO3=0,2.106=21,2(g)
Bài 2:
nC=3,6/12=0,3(mol)
C+ O2 -to-> CO2
nCO2=nC=0,3(mol)
=>V=V(CO2,đktc)=0,3.22,4=6,72(l)

Đáp án A
Vì khối lượng hỗn hợp X sử dụng ở hai trường hợp là như nhau và hóa trị của các kim loại kiềm luôn là I không đổi nên số mol electron trao đổi ở hai trường hợp bằng nhau.
Áp dụng định luật bảo toàn mol electron ta có:
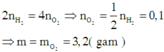

a)nO2=\(\dfrac{3.36}{22.4}\)=0,15(mol)
2KMnO4(to)→K2MnO4+MnO2+O2
Theo PT: nKMnO4=2nO2=0,3(mol)
→m=mKMnO4=0,3.158=47,4(g)
b)nH2=\(\dfrac{8.96}{22.4}\)=0,4(mol)
2H2+O2(to)→2H2O
Vì \(\dfrac{nH_2}{2}\)<nO2→O2nH2 dư
Theo PT: nH2O=nH2=0,4(mol)
→mH2O=0,4.18=7,2(g)
$n_{Ca} = \dfrac{4}{40} = 0,1(mol)$
$n_{O_2} = \dfrac{1,68}{22,4} = 0,075(mol)$
$2Ca + O_2 \xrightarrow{t^o} 2CaO$
Ta thấy :
$n_{Ca} : 2 < n_{O_2} : 1$ nên $O_2$ dư
$n_{CaO} = n_{Ca} = 0,1(mol)$
$CaO + H_2O \to Ca(OH)_2$
$n_{Ca(OH)_2} = n_{CaO} = 0,1(mol)$
$m_{Ca(OH)_2} = 0,1.74 = 7,4(gam)$