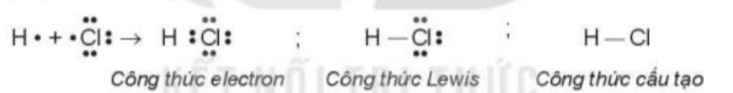
Nguyên tử halogen có thể nhận 1 electron từ nguyên tử kim loại hoặc góp chung electron với nguyên tử phi kim.
Mô tả sự hình thành liên kết trong phân tử NaCl và HCl để minh họa.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Liti mất 1e (3 – 1 = 2) lớp ngoài cùng nên ion Li mang điện tích +1
Nito thêm 3e (5 + 3 = 8) lớp ngoài cùng nên ion N mang điện tích –5 (N–5)
Công thức phân tử Li3N

Câu 16: Phát biểu không đúng về liên kết ion ?
A. Hình thành bởi liên kết giữa cation và anion.
B. Bởi cặp electron chung giữa hai nguyên tử kim loại.
C. Bởi nguyên tử kim loại điển hình và nguyên tử phi kim điển hình.
D. Do lực hút tĩnh điện giữa các ion mang điện tích trái dấu.
Câu 17:Trong hợp chất và ion nào sau đây nito có số oxi hóa -3 ?
A.NH4+ B.HNO3 C.NO2 D.NO2-
Câu 19:Hợp chất nào sau đây chứa liên kết cộng hóa trị không cực?
A.H2O B.H2 C.H2S D.NH3

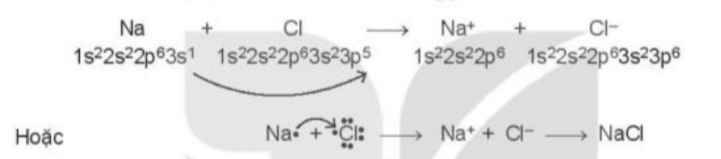
- Theo Hình 10.1 ta thấy:
+ Kim loại Na có 1 electron ở lớp vỏ ngoài cùng => Xu hướng nhường đi 1 electron để đạt cấu hình khí hiếm
+ Phi kim Cl có 7 electron ở lớp vỏ ngoài cùng => Xu hướng nhận thêm 1 electron để đạt cấu hình khí hiếm
=> Cl đã nhận thêm 1 electron từ Na để trở thành các ion
=> Phát biểu (1) phù hợp với sơ đồ phản ứng ở Hình 10.1

\(a.\left[Ne\right]3s^23p^5\\ b.2X\left(\left[Ne\right]3s^23p^5\right)+Ba\left(\left[Xe\right]6s^2\right)->2X^-\left(\left[Ar\right]\right)+Ba^{2+}\left(\left[Xe\right]\right)->BaX_2\)

Đáp án C
Điện tích hạt nhân X = Số p.(điện tích cơ bản) => số p = 17
=> cấu hình e : 1s22s22p63s23p5 (Clo)
=> Cl- có cấu hình e : 1s22s22p63s23p6
Chỉ có nhận định (3) sai. Cl2 vùa có tính khử , vừa có tính oxi hóa
=>C
Mô tả sự hình thành liên kết trong phân tử NaCl: Nguyên tử Na sẽ nhường 1 electron để tạo thành \(Na^+\), nguyên tử Cl sẽ nhận 1 electron để tạo thành \(Cl^-\)
=>Na+ và Cl- sẽ kết hợp với nhau để tạo thành liên kết ion
Mô tả sự hình thành liên kết trong phân tử HCl: Nguyên tử H và nguyên tử Cl liên kết với nhau bằng cách mỗi nguyên tử góp 1 electron. Khi đó, nguyên tử hidro có 2e(thỏa mãn cấu hình khí hiếm gần nhất của H là Heli), nguyên tử Cl có 8e(thỏa mãn cấu hình khí hiếm gần nhất của Cl là Ar), thỏa mãn quy tắc bát tứ
- Sự hình thành liên kết trong phân tử NaCl: Nguyên tử chlorine đã nhận 1 electron của nguyên tử sodium để tạo thành Na+ và Cl-
- Sự hình thành liên kết trong phân tử HCl: Mỗi nguyên tử góp 1 electron tạo thành 1 cặp electron dùng chung trong phân tử HCl