Tra cứu số liệu Bảng 6.1, Bảng 6.2 và Hình 6.2 để hoàn thành bảng mô tả một số đặc điểm cấu tạo của các nguyên tử halogen theo mẫu sau:
Nguyên tử | Lớp electron ngoài cùng | Bán kính nguyên tử | Độ âm điện |
Fluorine | ? | ? | ? |
Chlorine | ? | ? | ? |
Bromine | ? | ? | ? |
Iodine | ? | ? | ? |
Từ bảng số liệu thu được, hãy:
a) Giải thích tại sao nguyên tử halogen có xu hướng nhận 1 electron từ nguyên tử kim loại, hoặc góp chung 1 electron với nguyên tử phi kim, để hình thành liên kết.
b) Nêu và giải thích xu hướng biến đổi bán kính nguyên tử, độ âm điện của các nguyên tử halogen. Từ đó dự đoán xu hướng biến đổi tính oxi hóa từ F đến I
c) Dựa vào cấu hình electron lớp ngoài cùng và độ âm điện, giải thích tại sao nguyên tử fluorine chỉ có số oxi hóa -1 trong các hợp chất?





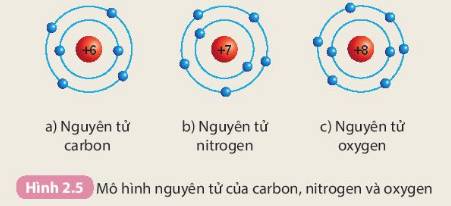

Nguyên tử
Lớp electron ngoài cùng
Bán kính nguyên tử
Độ âm điện
Fluorine
2s22p6
73
3,98
Chlorine
3s23p6
103
3,16
Bromine
4s24p6
119
2,96
Iodine
5s25p6
142
2,66
a)
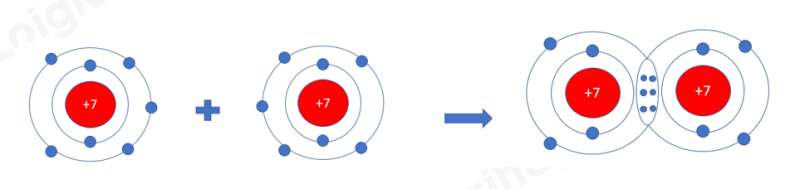
- Nguyên tử halogen có 7 electron ở lớp ngoài cùng, dễ nhận thêm 1 electron để đạt được cấu hình electron bền cùng khí hiếm gần nhất.
+ Khi nguyên tử halogen liên kết với kim loại => Khi đó kim loại sẽ nhường electron và nguyên tử halogen sẽ nhận 1 electron để trở thành ion mang điện tích âm
+ Khi nguyên tử halogen liên kết với phi kim => 2 phi kim kết hợp với nhau tạo thành phân tử, chúng sẽ góp electron để tạo thành các cặp electron dùng chung => Halogen sẽ góp chung 1 electron để đạt cấu hình electron bền vững
b)
- Bán kính nguyên tử: Đi từ trên xuống dưới, số lớp electron tăng => Lực hút giữa hạt nhân và lớp electron ngoài cùng giảm dần => Bán kính tăng dần
- Độ âm điện: Đi từ trên xuống dưới, số lớp electron tăng => Lực hút giữa hạt nhân với các electron lớp ngoài cùng giảm nên độ âm điện giảm
- Từ F đến I, độ âm điện giảm dần => Khả năng hút (nhận) electron giảm dần => Tính oxi hóa giảm dần
c)
- Nguyên tử fluorine có 7 electron ở lớp ngoài cùng và có độ âm điện lớn nhất
=> Khi tham gia liên kết hóa học, fluorine chỉ nhận 1 electron từ các nguyên tử khác
=> Fluorine chỉ có số oxi hóa -1 trong các hợp chất