Cho 20.3 gam hỗn hợp X gồm Zn và Al tác dụng với dd h2so4 10%(có dư). Sau khi phản ứng kết thúc, thu được dung dịch Y và V lít khí bay ra ở đktc. Cô cạn dung dịch Y thu được 65.9 gam hỗn hợp 2 muối khan.
a. tính giá trị V.
b. tính thành phần % theo khối lượng mỗi KL trong X.
c.Tính m dung dịch h2so4 cần dùng.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a)
$4Na + O_2 \xrightarrow{t^o} 2Na_2O$
$2Mg + O_2 \xrightarrow{t^o} 2MgO$
$4Al + 3O_2 \xrightarrow{t^o} 2Al_2O_3$
$2Na + 2HCl \to 2NaCl + H_2$
$Mg + 2HCl \to MgCl_2 + H_2$
$2Al + 6HCl \to 2AlCl_3 + 3H_2$
b)
Bảo toàn khối lượng : $m_{O_2} = 4,08 - 2,48 = 1,6(gam)$
$n_{O_2} = \dfrac{1,6}{32} = 0,05(mol)$
Đốt 2,48 gam X cần 0,05 mol $O_2$
Suy ra, đốt 4,96 gam X cần 0,1 mol $O_2$
Mà : \(\dfrac{1}{4}n_{Na}+\dfrac{1}{2}n_{Mg}+\dfrac{3}{4}n_{Al}=n_{O_2}=0,1\)
Theo PTHH :
\(n_{H_2}=\dfrac{1}{2}n_{Na}+n_{Mg}+\dfrac{3}{2}n_{Al}=2\left(\dfrac{1}{4}n_{Na}+\dfrac{1}{2}n_{Mg}+\dfrac{3}{4}n_{Al}\right)=2.0,1=0,2\)$V = 0,2.22,4 = 4,48(lít)$
$n_{HCl} = 2n_{H_2} = 0,4(mol)$
Bảo toàn khối lượng : $m = 4,96 + 0,4.36,5 - 0,2.2 = 19,16(gam)$

Đáp án C
Do thu được khí không màu và MZ = 37 ⇒ có 2 trường hợp.
TH1: Z gồm N2 và N2O. Đặt nN2 = x; nN2O = y
⇒ nZ = x + y = 0,2 mol; mZ = 28x + 44y = 7,4(g).
||⇒ giải hệ có: x = 0,0875 mol; y = 0,1125 mol. Đặt nNH4NO3 = a.
∑nNO3–/KL = ne = 10nN2 + 8nN2O + 8nNH4NO3 = (8a + 1,775) mol.
► mmuối khan = 25,3 + 62.(8a + 1,775) + 80a = 122,3(g) ⇒ a = – 0,02.. ⇒ loại!.
TH2: Z gồm NO và N2O. Đặt nNO = x; nN2O = y
⇒ nZ = x + y = 0,2 mol; mZ = 30x + 44y = 7,4(g).
||⇒ giải hệ có: x = y = 0,1 mol. Đặt nNH4NO3 = a.
∑nNO3–/KL = ne = 3nNO + 8nN2O + 8nNH4NO3 = (8a + 1,1) mol.
► mmuối khan = 25,3 + 62.(8a + 1,1) + 80a = 122,3(g) ⇒ a = 0,05 mol.
||⇒ nHNO3 = 4nNO + 10nN2O + 10nNH4NO3 = 1,9 mol

Đáp án C
Do thu được khí không màu và MZ = 37
⇒ có 2 trường hợp.
TH1: Z gồm N2 và N2O.
Đặt nN2 = x; nN2O = y
⇒ nZ = x + y = 0,2 mol; mZ = 28x + 44y = 7,4(g).
||⇒ giải hệ có: x = 0,0875 mol; y = 0,1125 mol.
Đặt nNH4NO3 = a.
∑nNO3–/KL = ne = 10nN2 + 8nN2O + 8nNH4NO3
= (8a + 1,775) mol.
► mmuối khan = 25,3 + 62.(8a + 1,775) + 80a = 122,3(g)
⇒ a = – 0,02.. ⇒ loại!.
TH2: Z gồm NO và N2O.
Đặt nNO = x; nN2O = y
⇒ nZ = x + y = 0,2 mol; mZ = 30x + 44y = 7,4(g).
⇒ giải hệ có: x = y = 0,1 mol. Đặt nNH4NO3 = a.
∑nNO3–/KL = ne = 3nNO + 8nN2O + 8nNH4NO3 = (8a + 1,1) mol.
► mmuối khan = 25,3 + 62.(8a + 1,1) + 80a
= 122,3(g) ⇒ a = 0,05 mol.
⇒ nHNO3 = 4nNO + 10nN2O + 10nNH4NO3 = 1,9 mol

Đáp án C
Do thu được khí không màu và MZ = 37 ⇒ có 2 trường hợp.
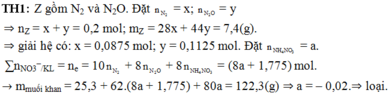
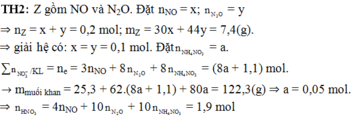

nZ = 0,2
Z gồm 2 khí không màu và có MZ = 7,4 ÷ 0,2 = 37
⇒ Trong Z có N2O (VìM = 44 > 37)
+TH1: Z gồm NO và N2O
Đặt nNO =a ; nN2O = b
nZ = a+b = 0,2 (1)
mZ = 30a + 44b = 7,4 (2)
Từ (1) và (2) ⇒ a = b = 0,1
Đặt nNH4+ = x ; nHNO3 ban đầu = y
Ta có nNO3- trong muối kl = ne = 8nN2O + 3n NO + 8nNH4NO3
Bảo toàn nguyên tố N: n HNO3 = n NO3- trong muối kl + n NO + 2nN2O + 2n NH4NO3
⇒ 10x + 4 . 0,1 + 10. 0,1 = y ⇒ 10x + 1,4 = y (*)
m muối = mNH4NO3 + mKL + mNO3-/muối kl
⇒ 80x + 25,3 + (8.0,1 + 3.0,1 + 8x ).62 = 122,3 (**)
Từ (*) và (**) ⇒ nHNO3 ban đầu = y = 1,9
Đáp án C
Tương tự với TH2: Z gồm N2 và N2O, không có đáp án thỏa mãn
Đáp án C.

Đáp án : B
Vì Z gồm 2 hợp chất không màu nên Z có NO và N2O
nZ = nNO + nN2O = 0,2 mol
Và mZ = 30nNO + 44nN2O = 7,4g
=> nNO = nN2O = 0,1 mol
Giả sử có tạo thành NH4NO3 x mol
=> bảo toàn e : ne trao đổi = nNO3 muối = 3nNO + 8nN2O + 8nNH4NO3 = 1,1 + 8x mol
=> mmuối = mKL + mNO3 muối + mNH4NO3
=> 122,3 = 25,3 + 62.( 1,1 + 8x) + 80x
=> x = 0,05 mol
=> nHNO3 = 4nNO + 10nN2O + 10nNH4NO3 = 1,9 mol


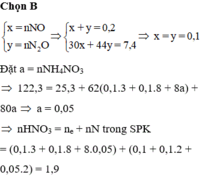

a) Gọi \(\left\{{}\begin{matrix}n_{Zn}=a\left(mol\right)\\n_{Al}=b\left(mol\right)\end{matrix}\right.\left(\text{Đ}K:a,b>0\right)\)
PTHH: Zn + H2SO4 ---> ZnSO4 + H2
a------>a---------->a----------->a
2Al + 3H2SO4 ---> Al2(SO4)3 + 3H2
b----->1,5b--------->0,5b------->1,5a
=> \(\left\{{}\begin{matrix}65a+27b=20,3\\161b+0,5a.342=65,9\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}a=0,25\\b=0,15\end{matrix}\right.\)
=> \(V=V_{H_2}=\left(0,25+0,15.1,5\right).22,4=10,64\left(l\right)\)
b) \(\left\{{}\begin{matrix}\%m_{Zn}=\dfrac{0,25.65}{20,3}.100\%=80,05\%\\\%m_{Al}=100\%-80,05\%=19,95\%\end{matrix}\right.\)
c) \(m_{\text{dd}H_2SO_4}=\dfrac{\left(0,25+1,5.0,15\right).98}{10\%}=465,5\left(g\right)\)