Lưu huỳnh (S) cháy trong không khí sinh ra khí sunfurơ (SO2). Phương trình hoá học của phản ứng là S + O2 → SO2. Hãy cho biết:
a) Những chất tham gia và tạo thành trong phản ứng trên, chất nào là đơn chất, chất nào là hợp chất? Vì sao?
b) Thể tích khí oxi (đktc) cần dùng để đốt cháy hoàn toàn 1,5 mol nguyên tử lưu huỳnh.
c) Khí sunfurơ nặng hay nhẹ hơn không khí?


 SO
SO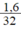 = 0,05 mol.
= 0,05 mol.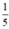 thể tích của không khí nên thể tích không khí cần là
thể tích của không khí nên thể tích không khí cần là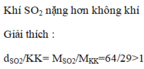

a. - Chất tham gia: S, \(O_2\)
- Chất sản phẩm: \(SO_2\)
- Đơn chất: S và \(O_2\) vì được tạo thành từ 1 nguyên tố hóa học
- Hợp chất: S\(O_2\) vì được tạo thành từ 2 nguyên tố hóa học
b. Theo PTHH ta có: \(n_{O2}=n_S=1,5mol\)
\(V_{O2}\)= 1,5 x 22,4 = 33,6 l
c. \(d_{\dfrac{SO2}{kk}}=\dfrac{64}{29}=2,2>1\)
=> Khí sunfuro nặng hơn kk
a)
- Chất tham gia: S;O2�;�2
- Chất sản phẩm: SO2��2
- Đơn chất: S� và O2�2 vì được tạo thành từ 11 nguyên tố hoá học
- Hợp chất: SO2��2 vì được tạo thành từ 22 nguyên tố hoá học
b) Theo PTHH: nO2=nS=1,5mol��2=��=1,5���
⇒VO2=1,5.22,4=33,6(l)⇒��2=1,5.22,4=33,6(�)
c)
Ta có: dSO2/kk=6429=2,2>1