Cho dung dịch X chứa cacl2 0,05m và hno3 0,10m. Bỏ qua sự điện li của nước a , viết phương trình điện li của các chất trong X b, tính nồng độ mol/l của các ion trong X
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


a)\(BaCl_2\rightarrow Ba^{2+}+2Cl^-\)
0,05 0,05 0,1
\(\left[Ba^{2+}\right]=0,05M\)
\(\left[Cl^-\right]=0,1M\)
b)\(HCl\rightarrow H^++Cl^-\)
0,1 0,1 0,1
\(\left[H^+\right]=0,1M\)
\(\left[Cl^-\right]=0,1M\)

1) \(BaCl_2\) 0,05M \(BaCl_2\rightarrow Ba^{2+}+2Cl^-\)
\(\left[Ba^{2+}\right]=0,05M\)
\(\left[Cl^-\right]=0,1M\)
2) \(HCl\) 0,1M \(HCl\rightarrow H^++Cl^-\)
\(\left[H^+\right]=0,1M\)
\(\left[Cl^-\right]=0,1M\)

- Đáp án A
- Do HNO3 là chất điện li mạnh nên nó phân li hoàn toàn trong dung dịch
HNO3 → H+ + NO3-
0,1 0,1 0,1 (M)
⇒ [H+ ] = [NO3- ] = 0,1M

- Đáp án D
- Do CH3COOH là chất điện li yếu nên trong nước chỉ phân li một phần
CH3COOH ⇌ H+ + CH3COO-
Vì vậy [H+] < [CH3COO-]= 0,1M

Chọn đáp án D
bazơ mạnh NaOH là một chất điện li mạnh, nếu bỏ qua sự điện li của nước → NaOH phân li hoàn toàn theo phương trình: NaOH → Na+ + OH–.
⇒ [OH–] = [NaOH] = 0,10M
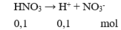
`a)CaCl_2 -> Ca^[2+]+2Cl^[-]`
`HNO_3 ->H^[+]+NO_3 ^[-]`
`b)`
`@[Ca^[2+]]=0,05(M)` `[Cl^-]=0,05.2=0,1(M)`
`@[H^+]=0,1(M)` `[NO_3 ^-]=0,1(M)`