Hợp chất MX2 tạo từ 2 ion M2+ và X- có cùng cấu hình electron. tổng số hạt cơ bản của phân tử X là 164 hạt trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 52 hạt. Nguyên tố M là ?
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Đáp án C.
Gọi p, e, n là số proton, số electron và số nơtron trong một nguyên tử M; p’, e’, n’ là số proton, số electron và số nơtron trong một nguyên tử X.
Trong nguyên tử số proton = số electron; các hạt mang điện là proton và electron, hạt không mang điện là nơtron.
+ Trong phân tử của M2X2 có tổng số hạt proton, nơtron và electron là 164 nên suy ra:
2(2p + n) + 2(2p’ + n’) = 164 (1)
+ Trong đó số hạt mang điện nhiều hơn hạt không mang điện là 52 nên suy ra:
(4p + 4p’) - 2(n + n’) = 52 (2)
+ Số khối của M lớn hơn số khối của X là 23 đơn vị nên ta có suy ra:
(p + n) - (p’ + n’) = 23 (3)
+ Tổng số hạt electron trong M+ nhiều hơn trong X22- là 7 hạt nên suy ra:
(2p + n - 1) - 2(2p’ + n’) + 2 = 7 (4)
Giải hệ (1), (2), (3), (4) ta được p = 19 ⇒ M là kali; p’ = 8 ⇒ X là oxi.
Công thức phân tử của hợp chất là K2O2.

Gọi p, e, n là số proton, số electron và số nơtron trong một nguyên tử M; p’, e’, n’ là số proton, số electron và số nơtron trong một nguyên tử X.
Trong nguyên tử số proton = số electron; các hạt mang điện là proton và electron, hạt không mang điện là nơtron.
+ Trong phân tử của M2X2 có tổng số hạt proton, nơtron và electron là 164 nên suy ra:
2(2p + n) + 2(2p’ + n’) = 164 (1)
+ Trong đó số hạt mang điện nhiều hơn hạt không mang điện là 52 nên suy ra:
(4p + 4p’) - 2(n + n’) = 52 (2)
+ Số khối của M lớn hơn số khối của X là 23 đơn vị nên ta có suy ra:
(p + n) - (p’ + n’) = 23 (3)
+ Tổng số hạt electron trong M+ nhiều hơn trong X22- là 7 hạt nên suy ra:
(2p + n - 1) - 2(2p’ + n’) + 2 = 7 (4)
Giải hệ (1), (2), (3), (4) ta được p = 19 ⇒ M là kali; p’ = 8 ⇒ X là oxi.
Công thức phân tử của hợp chất là K2O2.
*Tk

Tổng số hạt cơ bản của MX2 là 164. Nên ta có :
(1) 2ZM+NM+4ZX+2NX=164
Số hạt mang điện nhiều hơn số hạt không mang điện là 52 hạt. Nên ta có:
(2) (2ZM+4ZX) - (NM+NX)= 52
Số khối của X ít hơn số khối của M là 5. Nên ta được:
(3) (ZM+NM) - (ZX+NX)=5
Tổng số hạt cơ bản trong M nhiều hơn trong X là 8. Nên ta có:
(4) (2ZM+NM) - (2ZX+NX)= 8
Từ (1), (2), (3), (4) ta lập được hpt:
\(\left\{{}\begin{matrix}2Z_M+N_M+4Z_X+2N_X=164\\\left(2Z_M+4Z_X\right)-\left(N_M+2N_X\right)=52\\\left(Z_M+N_M\right)-\left(Z_X+N_X\right)=5\\\left(2Z_M+N_M\right)-\left(2Z_X+N_X\right)=8\end{matrix}\right.\\ \Leftrightarrow\left\{{}\begin{matrix}Z_M=20\\N_M=20\\Z_X=17\\N_X=18\end{matrix}\right.\\ \Rightarrow M:Canxi\left(Z_{Ca}=20\right);X:Clo\left(Z_{Cl}=17\right)\\ \Rightarrow CTHH:CaCl_2\)
+) Trong phân tử \(MX_2\) có tổng số hạt \(p,n,e\) bằng \(164\) hạt
\(\to 2P_M + N_M + 2(2P_X + N_X) = 164\)
+) Trong đó số hạt mag điện nhiều hơn hạt k mag điện là \(52\)
\(\to 2P_M + 2.2P_X - (N_M+2N_X) = 52\)
+) Số khối của nguyên tử \(M\) lớn hơn số khối của nguyên tử \(X\) là \(5\)
\(\to P_M + N_M - (P_X+N_X) = 5\)
+) Tổng số hạt \(p,n,e\) trog M lớn hơn trog X là 8\(\to 2P_M + N_M - (2P_X+N_X) = 8\)
Từ \((1)(2)(3)(4)\) ta được:\(\begin{cases} P_M = 20 \\ N_M = 20 \\ P_X = 17 \\ N_X = 18 \end{cases}\)
\(\text{Vậy M là caxi(Ca)}\)
\(\text{Vậy X là Cl} \rightarrow \text{ Công thức hợp chất : } CaCl_2\)

Bài toán không đơn thuần chỉ là tìm ra chất mà còn tích hợp cả kiến thức về tính chất hóa học của các chất. Nếu tìm được chất mà không nắm chắc tính chất hóa học của chất đó thì quá trình tìm chất trở nên vô nghĩa. Vì vậy để làm được bài này các bạn cần phải nắm chắc kiến thức về tính chất hóa học của các chất.
Gọi lần lượt là số proton, nơtron của M và X.
Theo giả thiết ta có:
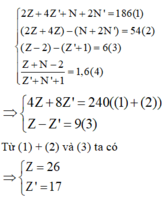
M là Fe và X là Cl.
Vậy hợp chất cần tìm là FeCl2
Xét các đáp án:
A: Đúng: kết tủa là AgCl
B: Sai: Dung dịch muối FeCl2 không làm thay đổi màu quỳ tím
C: Sai: FeCl2 là chất điện li mạnh
D: Sai: FeCl2 vừa thể hiện tính oxi hóa vừa thể hiện tính khử do Fe ở trạng thái oxi hóa trung gian
Đáp án A.

Theo đề bài ta có hệ PT sau :
\(\left\{{}\begin{matrix}2\left(2Z_M+N_M\right)+2Z_X+N_X=164\\4Z_M+2Z_X-\left(2N_M+N_X\right)=52\\\left(2Z_M+N_M\right)-\left(2Z_X+N_X\right)=10\\2Z_M-Z_X=22\end{matrix}\right.\)
=> \(\left\{{}\begin{matrix}Z_M=19\\N_M=20\\Z_X=16\\N_X=16\end{matrix}\right.\)
=>Vì ZM=19 nên M là Kali , ZX = 16 nên X là S
=> Hợp chất : K2S

Đáp án B
Gọi a, b là lần lượt tổng số proton và nơtron
Ta có: 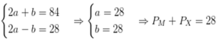
Ta có:
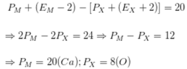
M là canxi ở ô 20, chu kì 4, nhóm IIA
Chọn B


Số hạt mang điện là: \(\dfrac{164+52}{2}=108\left(hạt\right)\)
=> Số e = \(\dfrac{108}{2}=54\left(hạt\right)\)
Do M2+ và X- có cùng cấu hình electron
=> M2+ và X- có cùng số electron
=> Trong mỗi ion có 18 electron
Nguyên tử M có 20 electron
=> Nguyên tử M có 20 proton
=> M là Ca