Làm chi tiết giúp em nha.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Ta có nFeO=0,03 mol= nFe(NO3)3
Bảo toàn nguyên tố N:
nN (HNO3)= nN (Fe(NO3)3)+ nN (khí X)→ 0,1=0,03.3+ nN(khí X)
→ nN(khí X)= 0,01 mol
QT cho e:
Fe+2→ Fe+3+ 1e
0,03 0,03 mol
Quá trình nhận e:
-Nếu khí có 1 nguyên tử N: Gọi a là số oxi hóa của N có trong khí X
N+5 + (5-a) e→ N+a
(5-a).0,01 0,01
Theo ĐL bảo toàn electron có: 0,03= 0,01(5-a) → a= +2 → X là khí NO
-Nếu khí X có 2 nguyên tử N: → nKhí= nN(khí)/2= 0,005 mol
2N+5 + 2(5-a) e→ N2+a
(5-a).0,01 0,005
Theo ĐL bảo toàn electron có: 0, 03= 0,01.(5-a) → a= +2→LOại
Vậy X là NO
Đáp án D


→ B T K L m = 0 , 07 . 56 + 0 , 04 . 64 + 0 , 12 . 96 + 0 , 0075 . 62 = 18 , 465 ( g a m )

nFeO = 0,03; Bảo toàn nguyên tố Fe ⇒ nFe(NO3)3 = 0,03
Bảo toàn nguyên tố N: nN/khí = nHNO3 – 3nFe(NO3)3 = 0,1 – 0,03.3 = 0,01
Nhận e:
N+5 + k(e) → Nx
0,01k ← 0,01 (mol)
Cho e:
Fe2+ → Fe3+ + 1e
0,03 → 0,03 (mol)
Áp dụng định luật bảo toàn e có: 0,01k = 0,03 ⇒ k =3
k =3 ⇒ x= 2 ⇒ Khí đó là NO
Đáp án D.

Đáp án D
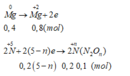
Theo ĐLBT electron ta có: 0,8 = 0,2.(5-n) => n=1. Vậy Z là N2O.


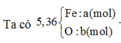

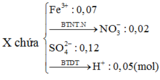
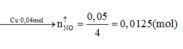
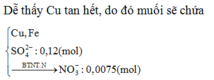


Gọi số e X nhận là n.
Theo ĐLBT e, có: 2nMg = n.nX ⇒ 2.0,04 = n.0,01 ⇒ n = 8
\(2N^{+5}+8e\rightarrow2N^{+1}\)
⇒ X là N2O.
Sao suy được X là N2O vậy ạ? 8e sao suy ra được vậy:<