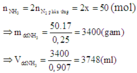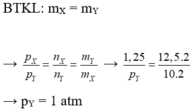Trong một bình kín dung tích không đổi 112 lít chứa N2 và H2 theo tỉ lệ thể tích là 1:4 ở 0 độ C và áp suất là 200atm với 1 ít xúc tác (thể tích không đáng kể). Nung bình một thời gian, sau đó đưa về 0 độ C thấy áp suất trong bình là 180atm. Tính hiệu suất phản ứng điều chế NH3
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Chọn B. nhh= 500 mol → nN2= 100 mol ; nH2= 400 mol.
N2 + 3H2 → 2NH3
| Mol đầu |
100 |
400 |
0 |
| Mol pứ |
x |
3x |
0 |
| Mol cb |
100-x |
400-3x |
2x |
n hh sau = (400-2x) mol
Đề cho
n1.P2=n2.P1 bới P2=0,95P1
0,95.400= 400-2x
x= 12,5 mol.
Tính hiệu suất theo N2 → H%= 12,5 % (Tính hiệu suất theo chất nào mà kết quả ra cao hơn)

Đáp án D.
Ban đầu: nhỗn hợp= PV/RT= 56.200/0,082.273= 500 mol
→nN2=100 mol, nH2= 400 mol

Sau khi phản ứng xảy ra đưa về 00C thì áp suất trong bình giảm 10% so với áp suất ban đầu
→Số mol khí cũng giảm 10%
→nkhí sau pứ= 500- 10%.500= 450 mol
Mà nkhí sau pứ= (100-x)+ (400-3x)+2x= 450
→x=25 mol
→H= (x/100).100%=25%

Đáp án A
N2 và H2 theo tỷ lệ thể tích là 1 : 4 tính hiệu suất theo N2
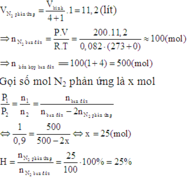

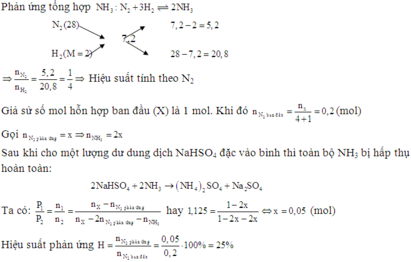
Đáp án C.
STUDY TIP: Việc đặt số mol hỗn hợp ban đầu bằng 1 mol giúp quá trình tính toán đơn giản hơn, do đó nó rất hiệu quả để giải nhanh các bài tập trắc nghiệm.

Đáp án C.
N2+ 3H2 ⇌ 2NH3
Vì có  nên hiệu suất phản ứng tính theo N2 hoặc H2
nên hiệu suất phản ứng tính theo N2 hoặc H2
Giả sử ban đầu có 1 mol N2 và 3 mol H2, nkhí ban đầu= 4 mol
→nN2 pứ= 1.20%= 0,2 mol
N2+ 3H2 ⇌ 2NH3
Ban đầu 1 3 mol
Phản ứng 0,2 0,6 0,4 mol
Sau pứ 0,8 2,4 0,4 mol
nkhí sau pứ= 0,8 + 2,4 + 0,4= 3,6 mol
Trong cùng điều kiện nhiệt độ và thể tích thì tỉ lệ về số mol chính là tỉ lệ về áp suất


Đáp án A
Đặt nC2H4 ban đầu = x mol; nH2 = y mol.
Ta có MY = 18 → H2 dư; hhY gồm C2H6 và H2 dư.
Theo BTKL: mX = mY = 28x + 2y gam.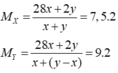
→ y = 5x → hhY gồm x mol C2H6 và 4x mol H2.
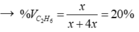

Đáp án B
Có ![]()
Gọi công thức hidrocacbon A là ![]() và nA = a.
và nA = a.
Có phản ứng:
![]()
a ka a
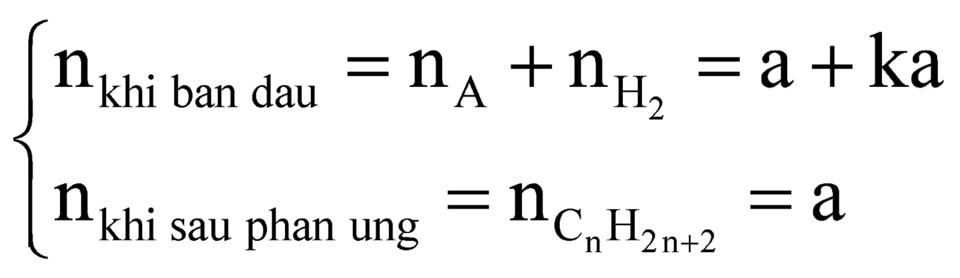
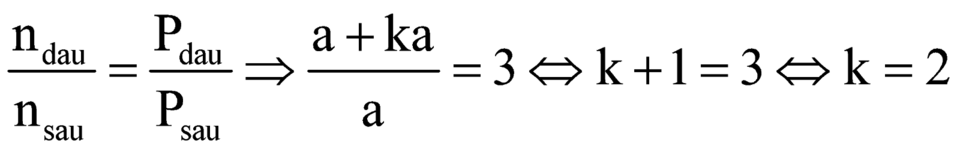
Mặt khác:
![]()
![]() .
.
Vậy A là C2H2.