Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

PTHH: \(Fe+H_2SO_{4\left(l\right)}\rightarrow FeSO_4+H_2\uparrow\)
\(2Fe+6H_2SO_{4\left(đ\right)}\underrightarrow{t^o}Fe_2\left(SO_4\right)_3+3SO_2\uparrow+6H_2O\)
\(Cu+2H_2SO_{4\left(đ\right)}\underrightarrow{t^o}CuSO_4+SO_2\uparrow+2H_2O\)
Ta có: \(\left\{{}\begin{matrix}n_{Fe}=n_{H_2}=0,1\left(mol\right)\\n_{SO_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\end{matrix}\right.\) \(\Rightarrow\left\{{}\begin{matrix}n_{Fe}=0,1\left(mol\right)\\n_{Cu}=0,05\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow m_{Cu}+m_{Fe}=0,1\cdot56+0,05\cdot64=8,8\left(g\right)\)
Giả sử: \(\left\{{}\begin{matrix}n_{Cu}=x\left(mol\right)\\n_{Fe}=y\left(mol\right)\end{matrix}\right.\)
_ Khi pư với H2SO4 loãng.
Theo ĐLBT mol e, có: 2y = 0,1.2 ⇒ y = 0,1 (mol) (1)
_ Khi pư với H2SO4 đặc nóng.
Ta có: \(n_{SO_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\)
Theo ĐLBT mol e, có: 2x + 3y = 0,2.2 (2)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}x=0,05\left(mol\right)\\y=0,1\left(mol\right)\end{matrix}\right.\)
⇒ m = mCu + mFe = 0,05.64 + 0,1.56 = 8,8 (g)
Bạn tham khảo nhé!

Đáp án : A
nH2 = 0,25 mol; nSO2 = 0,3 mol
2H+ + 2e → H2 S+6 + 2e → S+4
0,5 <-- 0,25 0,6 <-- 0,3
nFe = 0,6 – 0,5 = 0,1 mol
=> mFe = 5,6g

a, \(n_{H_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\\ n_{SO_2}=\dfrac{10,08}{22,4}=0,45\left(mol\right)\)
PTHH:
Zn + H2SO4 (loãng) ---> ZnSO4 + H2
0,2<--------------------------------------0,2
Zn + 2H2SO4 (đặc) ---> ZnSO4 + SO2↑ + 2H2O
0,2--->0,4------------------------------->0,2
Cu + 2H2SO4 ---> CuSO4 + SO2↑ + 2H2O
0,2<--0,4<------------------------0,2
b, \(\left\{{}\begin{matrix}m_{Zn}=0,2.65=13\left(g\right)\\m_{Cu}=0,2.64=12,8\left(g\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}\%m_{Zn}=\dfrac{13}{13+12,8}.100\%=50,4\%\\\%m_{Cu}=100\%-50,4\%=49,6\%\end{matrix}\right.\)
c, PTHH:
SO3 + H2O ---> H2SO4
0,4<---------------0,4
2SO2 + O2 --to, V2O5--> 2SO3
0,4<---------------------------0,4
4FeS2 + 11O2 --to--> 2Fe2O3 + 8SO2
0,2<--------------------------------------0,4
=> \(m_{FeS_2}=\dfrac{0,2.120}{100\%-20\%}=30\left(g\right)\)

nH2=4,48/22,4=0,2 mol
Fe +2HCl -->FeCl2+H2
0,2 0,2 mol
=>mFe=0,2*56=11,2 g
nSO2=10,08/22,4=0,45 mol
gọi số mol của Cu là a mol
bảo toàn e ta có
Cu\(^0\)-->Cu\(^{+2}\)+2e
a 2a S\(^{+6}\) + 2e -->S\(^{+4}\)
Fe\(^0\)--> Fe\(^{+3}\)+3e 0,45 0,9
0,2 0,6
=>a=0,15=>mCu=0,15*64=9,6 g
=>mhh=9,6+11,2=20,8g
=>%Cu=9,6*100/20,8=46,15%

a, Gọi \(\left\{{}\begin{matrix}n_{Al}=a\left(mol\right)\\n_{Zn}=b\left(mol\right)\end{matrix}\right.\left(đk:a,b>0\right)\)
\(n_{H_2}=\dfrac{7,28}{22,4}=0,35\left(mol\right)\)
PTHH:
2Al + 3H2SO4 ---> Al2(SO4)3 + 3H2
a--------------------------------------->1,5a
Zn + H2SO4 ---> ZnSO4 + H2
b------------------------------>b
Theo bài ra, ta có hệ: \(\left\{{}\begin{matrix}27a+65b=10,55\\1,5a+b=0,35\end{matrix}\right.\)
\(\Leftrightarrow\left\{{}\begin{matrix}a=0,15\left(mol\right)\\b=0,1\left(mol\right)\end{matrix}\right.\left(TM\right)\)
\(\rightarrow\left\{{}\begin{matrix}m_{Al}=0,15.27=4,05\left(g\right)\\m_{Fe}=0,1.56=5,6\left(g\right)\end{matrix}\right.\)
\(\rightarrow\left\{{}\begin{matrix}\%m_{Al}=\dfrac{4,05}{10,55}.100\%=38,4\%\\\%m_{Zn}=100\%-38,4\%=61,6\%\end{matrix}\right.\)
b, PTHH:
\(Zn+2H_2SO_{4\left(đặc,nguội\right)}\rightarrow ZnSO_4+SO_2\uparrow+2H_2O\)
0,1------------------------------>0,1----->0,1
\(2Al+3ZnSO_4\rightarrow Al_2\left(SO_4\right)_3+3Zn\downarrow\)
\(\dfrac{1}{15}\)<---0,1---------->\(\dfrac{1}{30}\)---------->0,1
\(Zn+2H_2SO_{4\left(đặc,nguội\right)}\rightarrow ZnSO_4+SO_2\uparrow+2H_2O\)
0,1----------------------------->0,1-------->0,1
\(\rightarrow\left\{{}\begin{matrix}V=\left(0,1+0,1\right).22,4=4,48\left(l\right)\\x=\dfrac{1}{30}.342+0,1.161=27,5\left(g\right)\end{matrix}\right.\)
\(a.Đặt:\left\{{}\begin{matrix}n_{Al}=x\left(mol\right)\\n_{Zn}=y\left(mol\right)\end{matrix}\right.\\ 2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\\ Zn+H_2SO_4\rightarrow ZnSO_4+H_2\\ \Rightarrow\left\{{}\begin{matrix}27x+65y=10,55\left(g\right)\\\dfrac{3}{2}x+y=\dfrac{7,28}{22,4}=0,325\left(mol\right)\end{matrix}\right.\\ \Rightarrow\left\{{}\begin{matrix}x=0,15\\y=0,1\end{matrix}\right.\\ \%m_{Al}=\dfrac{0,15.27}{10,55}.100=38,39\%;\%m_{Zn}=61,61\%\\ b.X+H_2SO_4đặc,nguội\Rightarrow ChỉcóZnphảnứng\\ Zn\rightarrow Zn^{2+}+2e\\ S^{+6}+2e\rightarrow S^{+4}\\ Bảotoàne:n_{Zn}.2=n_{SO_2}.2\\ \Rightarrow n_{SO_2}=0,1\left(mol\right)\\ \Rightarrow V_{SO_2}=0,1.22,4=2,24\left(l\right)\\ n_{ZnSO_4}=n_{Zn}=0,1\left(mol\right)\\ \Rightarrow m_{ZnSO_4}=161.0,1=16,1\left(g\right)\)
Lưu ý: Al bị thụ động với H2SO4 dặc nguội
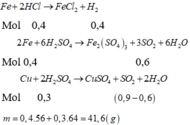
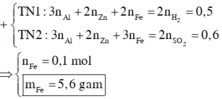
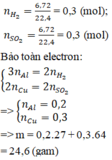


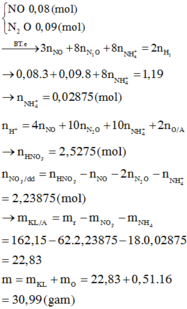
với : \(H2SO4\) loãng:
\(BTe:nH2=1,5nAl+nZn+nMg\)
\(với\) \(H2SO4\) đặc :
\(BT.e:nSO2=1,5nAl+nZn+nMg\)
\(->nSO2=nH2\)
\(->VSO2=VH2=4,48(l)\)