hỗn hợp A gồm 5l N2 và 10l H2, kích thích tia lửa điện để phản ứng xảy ra thu được hỗn hợp khí B có V=10l.
a, tính thành phần phần trăm về thể tích của hỗn hợp B. b, tính hiệu suật của phản ứng. c, tính dB/kk biết các chất khí đo ở cùng đkHãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Đáp án D
Dễ thấy hiệu suất tính theo N2.
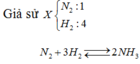
Bd: 1 4
Pu: 0,4→1,2→0,8
Sau: 0,6 2,8 0,8
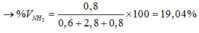

Đáp án D
Dễ thấy hiệu suất tính theo N2
Giả sử X N 2 : 1 H 2 : 4
![]()

a) Gọi số mol N2, H2 là a, b (mol)
Có: \(\overline{M}_A=\dfrac{28a+2b}{a+b}=7,5.2=15\left(g/mol\right)\)
=> 13a = 13b
=> a = b
=> \(\left\{{}\begin{matrix}\%m_{N_2}=\dfrac{28a}{28a+2b}.100\%=93,33\%\\\%m_{H_2}=\dfrac{2b}{28a+2b}.100\%=6,67\%\end{matrix}\right.\)
b) Giả sử A chứa 1 mol N2, 1 mol H2
PTHH: N2 + 3H2 --to,p,xt--> 2NH3
Xét tỉ lệ: \(\dfrac{1}{1}>\dfrac{1}{3}\) => Hiệu suất tính theo H2
Gọi số mol H2 phản ứng là 3a
PTHH: N2 + 3H2 --to,p,xt--> 2NH3
Trc pư: 1 1 0
Pư: a<--3a--------------->2a
Sau pư: (1-a) (1-3a) 2a
=> \(\overline{M}_B=\dfrac{\left(1-a\right).28+\left(1-3a\right).2+17.2a}{\left(1-a\right)+\left(1-3a\right)+2a}=9,375.2=18,75\left(g/mol\right)\)
=> a = 0,2
=> \(H\%=\dfrac{0,2.3}{1}.100\%=60\%\)

Các PTHH:
Fe + S → FeS (1)
FeS + 2HCl → Fe Cl 2 + H 2 S (2)
Fe(dư) + 2HCl → Fe Cl 2 + H 2 (3)
HCl (dư) + NaOH → NaCl + H 2 O (4)
Thành phần của hỗn hợp khí A :
Theo (1) : 0,05 mol Fe tác dụng với 0,05 mol S, sinh ra 0,05 mol FeS.
Theo (2) : 0,05 mol FeS tác dụng với 0,10 mol HCl, sinh ra 0,05 mol H 2 S
Theo (3) : 0,05 moi Fe dư tác dụng với 0,10 mol HCl, sinh ra 0,05 mol HCl
Kết luận : Hỗn hợp khí A có thành phần phần trăm theo thể tích :
50% khí H 2 S và 50% khí H 2

Đáp án B
Chọn thể tích ban đầu của N2 là 1 lít, H2 là 3 lít
→ Thể tích ban đầu là 4 lít
→Thể tích khí giảm là Vkhí giảm= 1/10.Vban đầu= 1/10.4= 0,4 lít
→VNH3 sinh ra= Vban đầu- Vsau= Vkhí giảm= 0,4 lít
N2+ 3H2![]() 2NH3
2NH3
VN2 pứ= 1/2VNH3 sỉnh = 0,2 lít,
VH2 pứ= 3/2.VNH3sinh= 0,6 lít
→VN2 dư= 0,8 lít, VH2 dư= 3-0,6= 2,4 lít
Tổng thể tích khí sau phản ứng là:
Vsau=9/10.Vban đầu= 0,9.4= 3,6 lít
→%VN2 dư= 0,8.100%/3,6=22,22%;
%VH2 dư= 2,4.100%/3,6=66,67%
%VNH3=11,11%



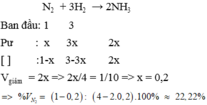
a) Gọi \(n_{N_2\left(pư\right)}=a\left(l\right)\left(a\le5\right)\)
PTHH: \(N_2+3H_2\xrightarrow[]{t^o,p,xt}2NH_3\)
a---->3a---------->2a
`=>` \(B:\left\{{}\begin{matrix}N_2:5-a\left(l\right)\\H_2:10-3a\left(l\right)\\NH_3:2a\left(l\right)\end{matrix}\right.\)
`=>` \(5-a+10-3a+2a=10\)
`=> a = 2,5 (l)`
`=>` \(\left\{{}\begin{matrix}\%V_{N_2\left(dư\right)}=\dfrac{5-2,5}{10}.100\%=25\%\\\%V_{H_2\left(dư\right)}=\dfrac{10-3.2,5}{10}.100=25\%\\\%V_{NH_3}=100\%-25\%-25\%=50\%\end{matrix}\right.\)
b) Xét tỉ lệ: \(\dfrac{V_{N_2}}{1}>\dfrac{V_{H_2}}{3}\left(\dfrac{5}{1}>\dfrac{10}{3}\right)\Rightarrow\) Hiệu suất phản ứng tính theo `H_2`
`=>` \(H=\dfrac{3.2,5}{10}.100\%=75\%\)
c) Giá sử có 1 mol B, do các khí đo ở cùng đk
`=>` \(\left\{{}\begin{matrix}n_{N_2}=0,25\left(mol\right)\\n_{H_2}=0,25\left(mol\right)\\n_{NH_3}=0,5\left(mol\right)\end{matrix}\right.\)
`=>` \(M_B=\dfrac{0,25.28+0,25.2+0,5.17}{1}=16\left(g/mol\right)\)
`=>` \(d_{B/kk}=\dfrac{16}{29}\approx0,552\)
cảm ơn ạ