Cho hỗn hợp chứa x mol Mg và 0,2 mol Fe vào 200 ml dung dịch hỗn hợp Fe2(SO4)3 1M và CuSO4 1M, đến phản ứng hoàn toàn thu được dung dịch X và 18,4 gam chất rắn. Giá trị của x là
K
Khách
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Những câu hỏi liên quan
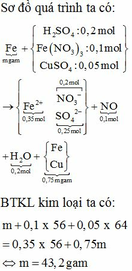




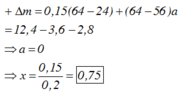


$n_{Fe_2(SO_4)_3} = 0,2(mol) ; n_{CuSO_4} = 0,2(mol)$
\(Mg+Fe_2\left(SO_4\right)_3\rightarrow MgSO_4+2FeSO_4\)
0,2 0,2 0,4 (mol)
\(Mg+CuSO_4\rightarrow MgSO_4+Cu\)
(x-0,2) (x-0,2) (x - 0,2) (mol)
$n_{CuSO_4\ còn} = 0,2 - (x - 0,2) = 0,4 -x (mol)
\(Fe+CuSO_4\rightarrow FeSO_4+Cu\)
0,4-x 0,4-x 0,4-x (mol)
Sau phản ứng : $n_{Cu} = 0,2(mol) ; n_{Fe\ dư} = 0,2 - (0,4 - x) = x - 0,2(mol)$
$\Rightarrow 0,2.64 + (x - 0,2).56 = 18,4 \Rightarrow x = 0,3$
Thứ tự dãy điện hóa: Mg > Fe >H> Cu > Fe2+→Kim loại ra lần lượt có Cu, Fe, Mg
Xét chất rắn: Nếu Cu ra hết thì có 0,2.64=12,8 gam; mà giả thiết ra 18,4 gam
→chứng tỏ còn có 0,1 mol Fe ra nữa
Ta có sơ đồ phản ứng:
x mol Mg và 0,2 mol Fe + 0,4 mol Fe3+, 0,2 mol Cu2+, 0,8 mol SO42-
→ x mol Mg2+; 0,5 mol Fe2+; 0,8 mol SO42- + 0,1 mol Fe + 0,1 mol Cu
Bảo toàn nguyên tố Fe ta có: nFe2+ trong X= 0,2+ 0,4- 0,1= 0,5 mol
Bảo toàn điện tích trong dung dịch X ta có: 2x + 0,5.2= 0,8.2 → x= 0,3 mol