Hỗn hợp Zn, Cu nặng 4,825g được hoà tan bằng axit HNO3 đặc làm thoát ra 3,30
du* khí NO2 (đkc). Sau đó cô cạn dung dịch nhận được in gam muối khan. a. Tính % lượng mỗi kim loại và tính m? b. Tính thể tích khí thoát ra khi hoà tan hỗn hợp bằng H2SO, loảng? Bằng H2SO4
đặc nóng?

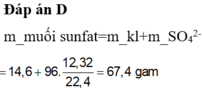
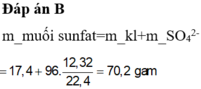
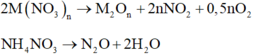
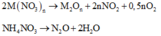
Gọi $n_{Zn} = a(mol) ; n_{Cu} = b(mol) \Rightarrow 65a + 64b = 4,825(1)$
$Zn + 4HNO_3 \to Zn(NO_3)_2 + 2NO_2 + 2H_2O$
$Cu + 4HNO_3 \to Cu(NO_3)_2 + 2NO_2 + 2H_2O$
Theo PTHH : $n_{NO_2} = 2a + 2b = \dfrac{3,36}{22,4} = 0,15(2)$
Từ (1)(2) suy ra: a = 0,025 ; b = 0,05
$\%m_{Zn} = \dfrac{0,025.65}{4,825}.100\% = 33,7\%$
$\%m_{Cu} = 100\% - 33,7\% = 66,3\%$
$m = 0,025.189 + 0,05.188 = 14,125(gam)$
b) $Zn + H_2SO_{4_{loãng}} \to ZnSO_4 + H_2$
$n_{H_2} = n_{Zn} = 0,025(mol) \Rightarrow V_{H_2} = 0,025.22,4 = 0,56(lít)$
$Zn + 2H_2SO_{4_{đặc}} \to ZnSO_4 + SO_2 + 2H_2O$
$Cu + 2H_2SO_{4_{đặc}} \to CuSO_4 + SO_2 + 2H_2O$
$n_{SO_2} = n_{Zn} + n_{Cu} = 0,075(mol)$
$V_{SO_2} = 0,075.22,4 = 1,68(lít)$