Từ các chất HCl, Al, CuO,KClo3 và các dụng cụ cần thiết .Viết PTHH điều chế ra các chất Al2O3, Cu.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.



a)Zn + 2HCl -> ZnCl2 + H2
Zn + H2SO4 -> ZnSO4 + H2
2Al + 6HCl -> 2AlCl3 + 3H2
2Al + 3H2SO4 -> Al2(SO4)3 + H2
2H2O -> (điện phân) 2H2 + O2
b) 2KMnO4 -> (t°) K2MnO4 + MnO2 + O2
2H2O -> (t°) 2H2 + O2

a/ \(2KMnO_4\rightarrow MnO_2+O_2+K_2MnO_4\)
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
Thực hiện biến đổi:
\(2Cu+O_2\rightarrow2CuO\)
\(CuO+H_2\rightarrow Cu+H_2O\)
b/ \(2KClO_3\rightarrow2KCl+3O_2\)
\(Fe+H_2SO_4\rightarrow FeSO_4+H_2\)
Thực hiện biến đổi
\(3Fe+2O_2\rightarrow Fe_3O_4\)
\(Fe_3O_4+4H_2\rightarrow3Fe+4H_2O\)

a) \(2KMnO4-->K2MnO4+MnO2+O2\)
\(Fe+2HCl-->FeCl2+H2\)
\(2Cu+O2-->2CuO\)
\(CuO+H2-->CuO+H2O\)
b) \(2KClO3-->2KCl+3O2\)
\(Zn+H2S04-->ZnSO4+H2\)
\(3Fe+2O2-->Fe3O4\)
\(Fe3O4+4H2-->3Fe+4H2O\)

2KMnO4-to>MnO2+K2MnO4+O2
2H2O-đp->2H2+O2
2Cu+O2-to>2CuO
3Fe+2O2-to>Fe3O4
4Al+3O2-to>2Al2O3
\(MnO_2:2KMnO_4\underrightarrow{t^o}K_2MnO_4+MnO_2+O_2\uparrow\\ CuO:2Cu+O_2\underrightarrow{t^o}2CuO\\ Fe_3O_4:3Fe+2O_2\underrightarrow{t^o}Fe_3O_4\\ Al_2O_3:4Al+3O_2\underrightarrow{t^o}2Al_2O_3\)

Điều chế MnO2 : \(2KMnO_4\xrightarrow[]{t^o}K_2MnO_4+MnO_2+O_2\)
\(2H_2O\xrightarrow[]{điện.phân}2H_2+O_2\)
Điều chế CuO : \(2Cu+O_2\xrightarrow[^{ }]{t^o}2CuO\)
Điều chế Fe3O4 : \(3Fe+2O_2\xrightarrow[]{t^o}Fe_3O_4\)
Điều chế Al2O3 : \(4Al+3O_2\xrightarrow[t^o]{}2Al_2O_3\)
Chúc bạn học tốt

a) Zn + 2HCl -> ZnCl2 + H2
2Al + 6HCl -> 2AlCl3 + 3H2
Zn + H2SO4 -> ZnSO4 + H2
2Al + 3H2SO4 -> Al2(SO4)3 + 3H2
2H2O -> (điện phân) 2H2 + O2
b) 2KMnO4 -> K2MnO4 + MnO2 + O2
2H2O -> (điện phân) 2H2 + O2

Cho Al tác dụng với dung dịch HCl:
2Al + 6HCl -> 2AlCl3 + 3H2
Cho H2 khử hỗn hợp oxit:
Fe2O3 + 3H2 -> (t°) 2Fe + 3H2O
CuO + H2 -> (t°) Cu + H2O
Thả hỗn hợp kim loại vào dung dịch HCl:
Fe + 2HCl -> FeCl2 + H2
Cứ không phản ứng
Lọc lấy Cu tinh khiết.
- Hòa tan hh vào dd HCl dư, thu đc dd gồm CuCl2, FeCl3, HCldư:
\(CuO+2HCl\rightarrow CuCl_2+H_2O\)
\(Fe_2O_3+6HCl\rightarrow2FeCl_3+3H_2O\)
- Thêm tiếp Al dư vào dd, thu được hh rắn gồm Cu, Fe, Aldư:
\(2Al+6HCl\rightarrow2AlCl_3+3H_2\)
\(2Al+3CuCl_2\rightarrow2AlCl_3+3Cu\)
\(Al+FeCl_3\rightarrow AlCl_3+Fe\)
- Hòa tan hh rắn vào dd HCl dư, chất rắn không tan là Cu
\(2Al+6HCl\rightarrow2AlCl_3+3H_2\)
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
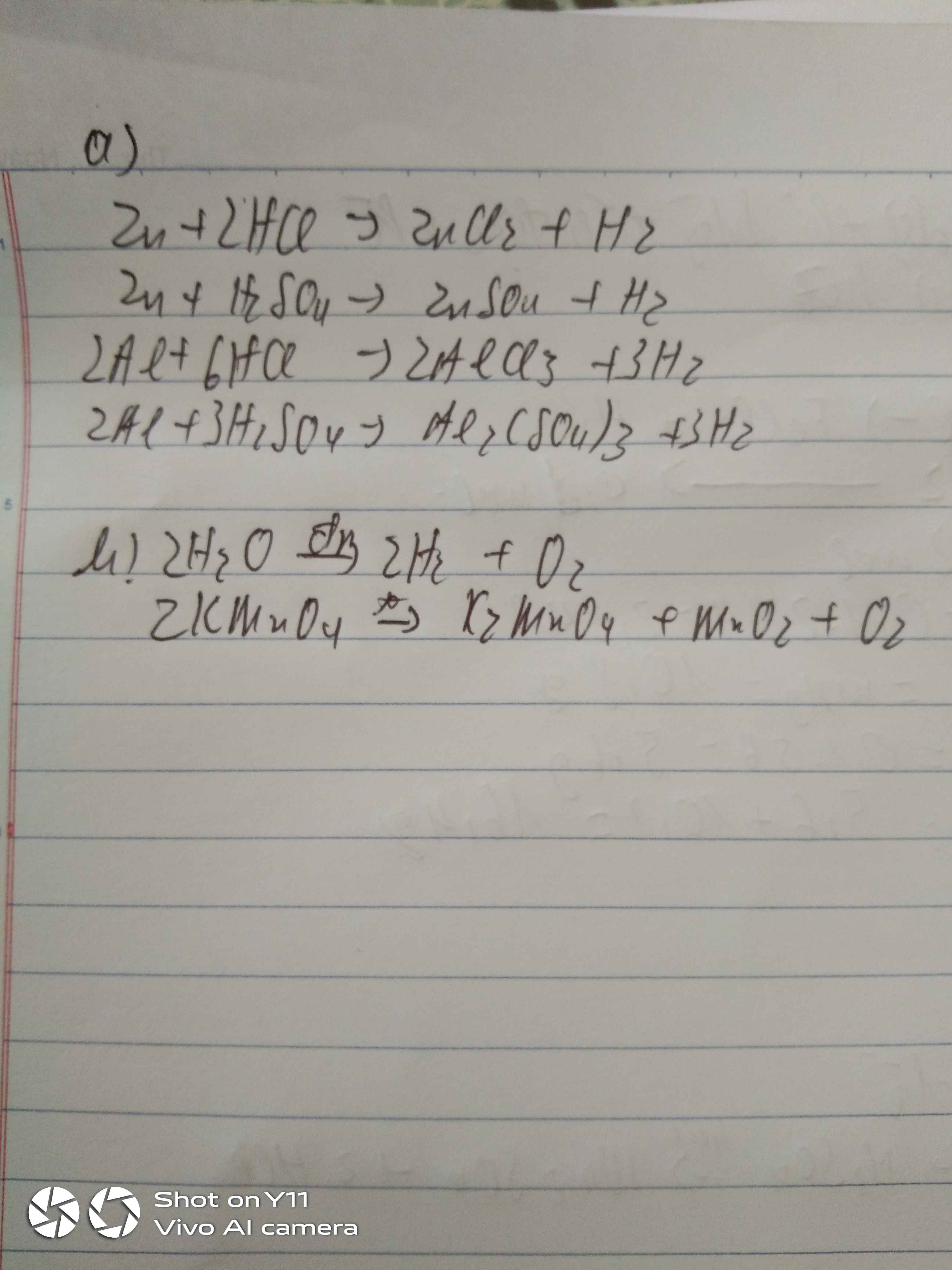
\(KClO_3\xrightarrow[MnO_2]{t^o}KCl+\dfrac{3}{2}O_2\uparrow\)
\(4Al+3O_2\underrightarrow{t^o}2Al_2O_3\)
\(CuO+2HCl\rightarrow CuCl_2+H_2O\)
\(2Al+3CuCl_2\rightarrow2AlCl_3+3Cu\)
KClO3-to>KCl +O2
Al+O2->toAl2O3
Al+HCl->AlCl3+H2
CuO+H2-to>Cu+H2O