Hòa tan 8,1 g kim loại R trong dung dịch H2SO4 đặc,nóng,dư thu được 10,08 lít khí SO2 (đktc)Tìm kim loại R
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Đáp án : B
. 2NaOH + SO3 -> Na2SO3 + H2O
=> mmuối = nNa2SO3.126 = nSO2.126 = 9,45g

Đáp án D
Giả sử R khi phản ứng với H2SO4 tạo ra ion Rn+ có số oxi hóa là +n
- Quá trình trao đổi e:
R → R+n + ne
S+6 + 2e → S+4
=> bảo toàn e: nR.n = 2nSO2 = 2.0,224/22,4 = 0,02 mol
Mà nR = mR / MR = 2,16 / R
=> n.2,16/R = 0,02
=> R = 108n => Với n = 1 thì R = 108 g/mol (Ag)

Đáp án A
Gọi M có số oxi hóa từ 0 lên +n
BT e: ta có: 8,1n/ M = 10,08. 2/ 22,4
Tìm được M = 9n.
Cặp nghiệm thỏa mãn là n= 3 và M= 27 (Al)
+ Al có thể tác dụng với dd HCl và NaOH
+ Al được điều chế bằng phương pháp điện phân nóng chảy
+ Độ dẫn điện của Al < Cu
+ Al là kim loại nhẹ ( 2,7 g/ cm^3)

Đáp án A
Gọi M có số oxi hóa từ 0 lên +n
BT e: ta có: 8,1n/ M = 10,08. 2/ 22,4
Tìm được M = 9n.
Cặp nghiệm thỏa mãn là n= 3 và M= 27 (Al)
+ Al có thể tác dụng với dd HCl và NaOH
+ Al được điều chế bằng phương pháp điện phân nóng chảy
+ Độ dẫn điện của Al < Cu
+ Al là kim loại nhẹ ( 2,7 g/ cm^3)

Đáp án C
Trong 15,2 gam hỗn hợp kim loại
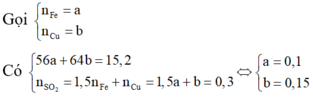
Do đó trong 1,52 gam hỗn hợp kim loại có 0,01 mol Fe.
Khi hòa tan 1,52 gam hỗn hợp kim loại vào dung dịch H2SO4 loãng dư thì nH = nF = 0,01
⇒ V H 2 = 0 , 224 ( lít )

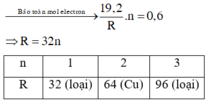
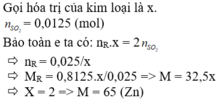


Gọi n là hóa trị của kim loại R
Ta có :
\(n_{SO_2} = \dfrac{10,08}{22,4} = 0,45(mol)\\ \)
Bảo toàn electron :
\(nn_R = 2n_{SO_2} \Rightarrow n_R = \dfrac{0,9}{n}(mol)\\ \Rightarrow \dfrac{0,9}{n}.R = 8,1\\ \Rightarrow R = 9n\)
Với n = 3 thì R = 27(Al)
Vậy kim loại R là Al
n SO2=10,08/22,4=0,45mol
TH1 R có hóa trị 1
2R + 2H2SO4 đ--> R2SO4 + SO2 + 2H2O
0,9 0,45 mol
=> M R=8,1/0,9=9=>R là Be loai vì Be hóa trị 2
TH2 nếu R có hóa trị 2
R + 2H2SO4 --> RSO4 + SO2 +2H2O
0,45 0,45 mol
=> M R =8,1/0,45=18=> là Ar loại vì Ar là khí hiếm
TH3 nếu r có hóa trị 3
2R + 6H2SO4--> R2(SO4)3 + 3SO2 + 6H2O
0,3 0,45 mol
=> M R =8,1/0,3=27 => R là Al chọn
vậy R là Al