có 15g hỗn hợp Al và Mg được chia làm hai phần bằng nhau. phần thứ nhất cho vào 600ml HCl nồng độ xM thu được khí A và dung dịch B. cô cạn dung dịch B thu được 27,9g muối khan. Phần thứ 2 cho vào 800mg dịch HCl nồng độ xM và làm tương tự thu được 32,35g muối khan
a) Xác định % khối lượng mỗi kim loại trong hỗn hợp và x
b) Tính thể tích H2(đktc) thu được sau khi thực hiện xong các thí nghiệm

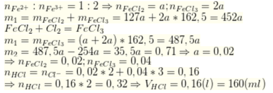
mn giúp mình bài này với ạ