Cho 27,2 gam hỗn hợp X gồm Fe và Ag tác dụng với dung dịch H2SO4 đặc nóng, dư, thu được 5,6 lít (đktc) khí SO2.
a) Tính phần trăm khối lượng mỗi kim loại trong hỗn hợp X
b) Hấp thu hết lượng S02 trên vào 500ml dung dịch NaOH 0,8M thu được dung dịch A. Tính nồng độ mol/l của chất tan có trong dung dịch A
Mọi người giúp em lời giải chi tiết vs ạ '< em cảm ơn:3

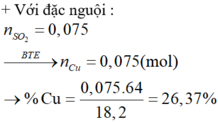


`2Fe + 6H_2 SO_[4(đ,n)] -> Fe_2(SO_4)_3 + 6H_2 O + 3SO_2 \uparrow`
`0,1` `0,15` `(mol)`
`2Ag + 2H_2 SO_[4(đ,n)] -> Ag_2 SO_4 + 2H_2 O + SO_2 \uparrow`
`0,2` `0,1` `(mol)`
`n_[SO_2]=[5,6]/[22,4]=0,25(mol)`
Gọi `n_[Fe]=x` ; `n_[Ag]=y`
`=>` $\left[\begin{matrix} 56x+108y=27,2\\ \dfrac{3}{2}x+\dfrac{1}{2}y=0,25\end{matrix}\right.$
`<=>` $\left[\begin{matrix} x=0,1\\ y=0,2\end{matrix}\right.$
`a)%m_[Fe]=[0,1.56]/[27,2] .100~~20,59%`
`=>%m_[Ag]~~100-20,59~~79,41%`
`b)n_[SO_2]=0,15+0,1=0,25(mol)`
`n_[NaOH]=0,5.0,8=0,4(mol)`
Ta có:`T=[0,4]/[0,25]=1,6 ->` Tạo muối `Na_2 SO_3` và `NaHSO_3`
`SO_2 + 2NaOH -> Na_2 SO_3 + H_2 O`
`SO_2 + NaOH -> NaHSO_3`
Gọi `n_[Na_2 SO_3]=x ; n_[NaHSO_3]=y`
`=>` $\left[\begin{matrix} x+y=0,25\\ 2x+y=0,4\end{matrix}\right.$
`<=>` $\left[\begin{matrix} x=0,15\\ y=0,1\end{matrix}\right.$
`=>C_[M_[Na_2 SO_3]]=[0,15]/[0,5]=0,3(M)`
`=>C_[M_[NaHSO_3]]=[0,1]/[0,5]=0,2(M)`
Lần sau chú ý dùng dấu \(\left\{{}\begin{matrix}\\\end{matrix}\right.\) ha, dấu \(\left[{}\begin{matrix}\\\end{matrix}\right.\) có ý nghĩa là xảy ra một trong các trường hợp còn dấu \(\left\{{}\begin{matrix}\\\end{matrix}\right.\) có ý nghĩa là đồng thời xảy ra