Nêu tính chất hoá học, nguyên liệu điều chế hidro trong phòng thí nghiệm. Viết PTHH minh hoạ.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


a) bạn tự học SGK
b) Nguyên liệu điều chế O2: KMnO4, KClO3, KNO3 (độc), H2O,...
2KMnO4 -> (t°) K2MnO4 + MnO2 + O2
2KClO3 -> (t°, MnO2) 2KCl + 3O2
2KNO3 -> (t°) 2KNO2 + O2
2H2O -> (đp) 2H2 + O2
Nguyên liệu điều chế H2: Pb, Zn, Fe, Al, HCl, H2SO4 loãng,...
Fe + 2HCl -> FeCl2 + H2
2Al + 3H2SO4 ->
Al2(SO4)3 + 3H2
2H2O -> (đp) 2H2 + O2

Cho chất oxi hoá mạnh tác dụng với dung dịch HCl đặc (từng chất oxi hoá mạnh để oxi hoá ion clorua Cl - thành đơn chất clo).
Mn O 2 + 4HCl → Mn Cl 2 + Cl 2 + 2 H 2 O
2KMn O 4 + 16HCl → 2KCl + 2Mn Cl 2 + 5 Cl 2 + 8 H 2 O
KCl O 3 + 6HCl → KCl + 3 Cl 2 + 3 H 2 O
CaO Cl 2 + 2HCl → Ca Cl 2 + Cl 2 + H 2 O
K 2 Cr 2 O 7 + 14HCl → 2KCl + 2Cr Cl 3 + 3 Cl 2 + 7 H 2 O

Điều chế Hidro :
\(Mg + 2HCl \to MgCl_2 + H_2\\ Fe + 2H_2SO_4 \to FeSO_4 + H_2\)
Điều chế oxi :
\(2KNO_3 \xrightarrow{t^o} 2KNO_2 + O_2\\ 2KClO_3 \xrightarrow{t^o} 2KCl + 3O_2\\ 2KMnO_4 \xrightarrow{t^o} K_2MnO_2 + MnO_2 + O_2\)
Điều chế khí H2:
Al + HCl ---> AlCl3 + H2.
Al + H2SO4 ---> Al2(SO4)3 + H2.
Zn + HCl ---> ZnCl2 + H2.
Zn + H2SO4 ---> ZnSO4 + H2.
Fe + HCl ---> FeCl2 + H2.
Fe + H2SO4 ---> FeSO4 + H2.
Điều chế khí O2:
2KMnO4 ---to---> K2MnO4 + MnO2 + O2.
2KClO3 ---to---> 2KCl + 3O2.
2KNO3 ---to---> KNO2 + O2.

a) Khi đốt cháy hidro sinh ra phản ứng
\(2H_2 + O_2 \xrightarrow{t^o} 2H_2O\)
Đây là phản ứng tỏa nhiều nhiệt, nước sinh ra vô hại. Do đó, hidro được coi là nguyên liệu sạch
b)
Trong phòng thí nghiệm :
\(Mg + 2HCl \to MgCl_2 + H_2\\ Fe + H_2SO_4 \to FeSO_4 + H_2\)
Trong công nghiệp :
\(2H_2O \xrightarrow{điện\ phân} 2H_2 + O_2\)
a. H2 là nhiên liệu sạch vì khi đốt không thải ra khí hại mà tạo ra hơi nước (cần thiết cho môi trường)
b. Điều chế H2:
*Trong phòng thí nghiệm: Cho 1 số kim loại (ví dụ Zn, Fe, Mg, ...) tác dụng với axit (HCl, H2SO4, ...)
\(Zn+H_2SO_4\rightarrow ZnSO_4+H_2\)
*Trong công nghiệp: Điện phân nước: \(2H_2O\underrightarrow{\text{điện phân}}2H_2+O_2\)

vật lý : là một chất không có mùi, không có màu sắc, không có vị. Oxi tan ít trong nước và có khối lượng nặng hơn không khí. Khi chịu áp suất của khí quyển thì oxi sẽ hóa lỏng ở -183 độ. Khi hóa lỏng sẽ có màu xanh nhạt.
hóa học
td với phi kim :
S+O2 -to-> SO2
td với Kim loại
2Zn + O2 -to -> 2ZnO
td với h/c
CH4 +2O2 -to-> CO2 +2H2O
ứng dụng : Oxi cần cho sự hộ hấ của con người và động vật , cần để đốt nhiên liệu trogn đời sống và sản suất
điều chế khí O2 bằng những chất dễ phân hủy và giàu oxii
- Tính chất hoá học:
+ Phản ứng với O2 ---> nước: \(2H_2+O_2\underrightarrow{t^o}2H_2O\)
+ Phản ứng với phi kim ---> hợp chất khí (axit không có oxi):
\(H_2+Cl_2\underrightarrow{\text{ánh sáng}}2HCl\)
\(H_2+S\underrightarrow{t^o}H_2S\)
+ Phản ứng với oxit kim loại (đứng sau Al) ---> kim loại + nước:
\(Fe_2O_3+3H_2\underrightarrow{t^o}2Fe+3H_2O\\ Ag_2O+H_2\underrightarrow{t^o}2Ag+H_2O\)
- Điều chế:
+ Nguyên liệu: Mg, Al, Pb, Zn, Fe, HCl, H2SO4 (loãng),...
+ Phương pháp: cho kim loại + axit ---> muối + H2
\(Mg+2HCl\rightarrow MgCl_2+H_2\\ 2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\\ Zn+2HCl\rightarrow ZnCl_2+H_2\\ Fe+H_2SO_4\rightarrow FeSO_4+H_2\)
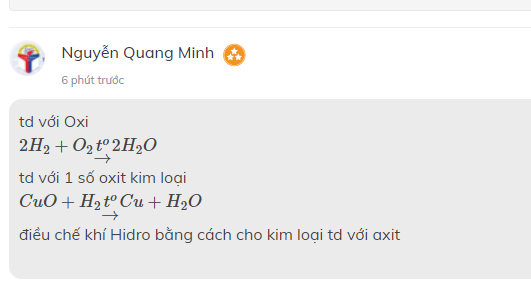
td với Oxi
\(2H_2+O_2\underrightarrow{t^o}2H_2O\)
td với 1 số oxit kim loại
\(CuO+H_2\underrightarrow{t^o}Cu+H_2O\)
điều chế khí Hidro bằng cách cho kim loại td với axit