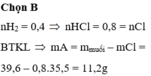cho 1 lượng hỗn hợp gồm Al và Fe tan hết trong dung dịch HCl thu đk 2,8 l H2 ở đktc và dung dịch A. Cô cạn dung dịch A thu được 13,025 g muối khan . Xác định % mỗi kim loại đã dùng
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Gọi x,y lần lượt là số mol của Al, Fe
Pt: 2Al + 6HCl --> 2AlCl3 + 3H2
......x..........................x............1,5x
......Fe + 2HCl --> FeCl2 + H2
......y.........................y..........y
nH2 = \(\dfrac{2,8}{22,4}=0,125\) mol
Ta có hệ pt: \(\left\{{}\begin{matrix}1,5x+y=0,125\\133,5x+127y=14,025\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}x=0,03\\y=0,08\end{matrix}\right.\)
mAl = 0,03 . 27 = 0,81 (g)
mFe = 0,08 . 56 = 4,48 (g)
mhh = mAl + mFe = 0,81 + 4,48 = 5,29 (g)
% mAl = \(\dfrac{0,81}{5,29}.100\%=15,3\%\)
% mFe = \(\dfrac{4,48}{5,29}.100\%=84,7\%\)
NH2=2,8/22,4=0,125(mol)
pt: 2Al+6HCl--->2AlCl3+3H2
a______________________3/2a
Fe+2HCl--->FeCl2+H2
b________________b
hệ pt:
\(\left\{{}\begin{matrix}\dfrac{3}{2}a+b=0,125\\133,5a+127b=14,025\end{matrix}\right.\)
=>a=0,03
b=0,08
mAl=0,03.27=0,81(g)
mFe=0,8.56=4,48(g)
mhh=0,81+4,48=5,29(g)
=>%mAl=0,81/5,29.100=15,3%
=>%mFe=100%-15,3%=84,7%

Gọi x,y lần lượt là số mol của Al,Fe
nH2 = \(\frac{2,8}{22,4}=0,125\) mol
Pt: 2Al + 6HCl --> 2AlCl3 + 3H2
......x.........................x............1,5x
......Fe + 2HCl --> FeCl2 + H2
.......y......................y.............y
Ta có hệ pt: \(\left\{\begin{matrix} 1,5x + y = 0,125 & & \\ 133,5x + 12y = 14,025 & & \end{matrix}\right.\)
\(\Leftrightarrow \left\{\begin{matrix} x = 0,03 & & \\ y = 0,08 & & \end{matrix}\right.\)
mAl = 0,03 . 27 = 0,81 (g)
mFe = 0,08 . 56 = 4,48 (g)
mhh = mAl + mFe = 0,81 + 4,48 = 5,29 (g)
% mAl = \(\frac{0,81}{5,29}\) . 100% = 15,31%
% mFe = \(\frac{4,48}{5,29}\) . 100% = 84,69%

a)
Gọi số mol Al, Fe là a, b
=> 27a + 56b = 8,3
PTHH: 2Al + 6HCl --> 2AlCl3 + 3H2
a----->3a------->a------>1,5a
Fe + 2HCl --> FeCl2 + H2
b------>2b------>b----->b
=> \(1,5a+b=\dfrac{5,6}{22,4}=0,25\left(mol\right)\)
=> a = 0,1; b = 0,1
=> \(\left\{{}\begin{matrix}\%Al=\dfrac{0,1.27}{8,3}.100\%=32,53\%\\\%Fe=\dfrac{0,1.56}{8,3}.100\%=67,47\%\end{matrix}\right.\)
b)
\(\left\{{}\begin{matrix}m_{AlCl_3}=0,1.133,5=13,35\left(g\right)\\m_{FeCl_2}=0,1.127=12,7\left(g\right)\end{matrix}\right.\)
=> mmuối = 13,35 + 12,7 = 26,05(g)
c)
nHCl = 3a + 2b = 0,5(mol)
=> \(V_{ddHCl\left(PTHH\right)}=\dfrac{0,5}{2}=0,25\left(l\right)\)
=> Vdd HCl(thực tế) = \(\dfrac{0,25.110}{100}=0,275\left(l\right)\)
d)
PTHH: 2FeCl2 + Cl2 --> 2FeCl3
0,1----------------->0,1
=> \(\left\{{}\begin{matrix}m_{FeCl_3}=0,1.162,5=16,25\left(g\right)\\m_{AlCl_3}=13,35\left(g\right)\end{matrix}\right.\)
=> mmuối = 16,25 + 13,35 = 29,6(g)

a) \(n_{AlCl_3}=\dfrac{6,675}{133,5}=0,05\left(mol\right)\)
PTHH: 2Al + 6HCl --> 2AlCl3 + 3H2
0,05<-----------0,05---->0,075
=> \(\%Al=\dfrac{0,05.27}{14,15}.100\%=9,54\%\)
=> \(\%Cu=\dfrac{14,15-0,05.27}{14,15}.100\%=90,46\%\)
b) \(V_{H_2}=0,075.22,4=1,68\left(l\right)\)
c) \(n_{Cu}=\dfrac{14,15-0,05.27}{64}=0,2\left(mol\right)\)
PTHH: 4Al + 3O2 --to--> 2Al2O3
0,05->0,0375
2Cu + O2 --to--> 2CuO
0,2-->0,1
=> \(V_{O_2}=\left(0,1+0,0375\right).22,4=3,08\left(l\right)\)
\(2Al+6HCl\rightarrow2AlCl_3+3H_2\\ m_{AlCl_3}=6,675\left(mol\right)\\ n_{AlCl_3}=\dfrac{6,675}{133,5}=0,05\left(mol\right)\\ \Rightarrow n_{Al}=n_{AlCl_3}=0,05\left(mol\right)\\ \Rightarrow m_A=0,05.27=1,35\left(g\right);m_{Cu}=14,15-1,35=12,8\left(g\right)\\ \%m_{Cu}=\dfrac{12,8}{14,15}.100\approx90,459\%\\ \Rightarrow\%m_{Al}\approx9,541\%\\ b,n_{Cu}=\dfrac{12,8}{64}=0,2\left(mol\right)\\ n_{H_2}=\dfrac{3}{2}.n_{Al}=\dfrac{3}{2}.0,05=0,075\left(mol\right)\\ \Rightarrow V=V_{H_2\left(đktc\right)}=0,075.22,4=1,68\left(l\right)\\ 4Al+3O_2\rightarrow\left(t^o\right)2Al_2O_3\\ 2Cu+O_2\rightarrow\left(t^o\right)2CuO\\ n_{O_2}=\dfrac{3}{4}.n_{Al}+\dfrac{1}{2}.n_{Cu}=\dfrac{3}{4}.0,05+\dfrac{1}{2}.0,2=0,0875\left(mol\right)\)
\(\Rightarrow V_{O_2\left(đktc\right)}=0,0875.22,4=1,96\left(l\right)\)

Đáp án B
nH2 = 0,4 => nHCl = 0,8 = nCl
BTKL => mA = mmuối – mCl = 39,6 – 0,8.35,5 = 11,2g

Cách 1: Dùng CT và BT điện tích
\(nNO=0,3mol\)
Mà \(nNO_3\) - trong muối \(=3nNO-=0,9mol\)
Muối \(=mKL+mNO_3-\rightarrow mKL=68,25-0,9.62=12,45\)
nFe = x mol , nAl = y mol
Muối bao gồm Fe3+ , Al3+ , NO3-
BTĐT : \(3x+3y=0,9\rightarrow x+y=0,3\)
\(56x+27y=12,45\)
Giải ra \(x=0,15;y=0,15\)
\(mFe=0,15.56=8,4g\)
\(mAl=4,05g\)
Bài này dễ ợt đi
Fe + 4HNO3 -> Fe(NO3)3 + NO + 2H2O (1)
Al + 4HNO3 -> Al(NO3)3 + NO + 2H2O (2)
nNO=0,3(mol)
Đặt nFe=nFe(NO3)3=nNO(1)=a
nAl=nAl(NO3)3=nNO(2)=b
Ta có:
\(\left\{{}\begin{matrix}242a+213b=68,25\\a+b=0,3\end{matrix}\right.\)
=>a=b=0,15
mFe=56.0,15=8,4(g)
mAl=27.0,15=4,05(g)