Hòa tan hoàn toàn 18g nhôm vào dung dịch H2SO4 loãng dư
a. Tính thể tích H2 tạo thành ở điều kiện tiêu chuẩn
b. Nếu dùng lượng H2 thu đc ở phản ứng trên cho phản ứng với 32g sắt 3 oxit đã đc nung nóng thì khối lượng sắt thu đc là bao nhiêu
c. Tính thể tích không khí chứa 20% thể tích oxi ở điều kiện tiêu chuẩn cần dùng để phản ứng vừa đủ với lượng Sắt thu đc ở trên.Bt sản phẩm sau p.ứng là Sắt II.III oxit
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Fe+H2SO4->FeSO4+H2
0,25--0,25-----0,25---0,25
CuO+H2-to>Cu+H2O
0,25----0,25
n Fe=0,25 mol
m H2SO4=0,25.98=24,5g
m H2=0,25.22,4=5,6l
m Cu=0,25.64=16g

a.b.\(n_{Fe}=\dfrac{5,6}{56}=0,1mol\)
\(Fe+H_2SO_4\left(l\right)\rightarrow FeSO_4+H_2\)
0,1 0,1 0,1 ( mol )
\(m_{FeSO_4}=0,1.152=15,2g\)
\(V_{H_2}=0,1.22,4=2,24l\)
c.\(PbO+H_2\rightarrow\left(t^o\right)Pb+H_2O\)
0,1 0,1 ( mol )
\(m_{Pb}=0,1.207=20,7g\)
nFe = 5,6 : 56 = 0,1 (mol)
pthh : Fe + H2SO4 -> FeSO4 + H2
0,1 0,1 0,1
mFeSO4 = 0,1 . 152 = 15,2 (G)
VH2 = 0,1 . 22,4 = 2,24 (L)
pthh : PbO + H2 -t-> Pb + H2O
0,1 0,1
mPb = 207 . 0,1 = 20,7 (G)

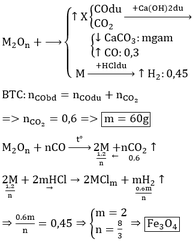
Dung dịch Ca(OH)2 không hấp thụ khí CO nên 6,72 lít khí thoát ra chính là khí CO dư.

a.
Sô mol của 4.8 Mg
nMg =\(\dfrac{m}{M}\)= \(\dfrac{4.8}{24}\) = 0.2 mol
PTHH: Mg + 2HCl \(\rightarrow\) MgCl2 +H2 \(\uparrow\)
Tỉ lệ: 1 2 1 1
Mol: 0.2 \(\rightarrow\) 0.2
b. Thể tích của khí H2 ở đktc:
VH2 = n . 22,4 = 0.2 . 22,4 = 4,48 lít
c Vì nH2 = 0.2 mol nên ta có:
PTHH: Fe2O3 + 3H2 \(\underrightarrow{t^0}\) 2Fe + 3H2O
Tỉ lệ: 1 3 2 3
Mol: 0.2 \(\rightarrow\) 0.13
Khối lượng chất rắn thu được:
mFe = n . M = 0.13 . 56 = 7.28g

\(a,PTHH:Fe+H_2SO_4\to FeSO_4+H_2\\ b,n_{H_2}=\dfrac{16,8}{22,4}=0,74(mol)\\ \Rightarrow n_{Fe}=0,75(mol)\\ \Rightarrow m_{Fe}=0,75.56=42(g)\\ c,n_{H_2SO_4}=\dfrac{245.10\%}{100\%.98}=0,25(mol)\)
Vì \(\dfrac{n_{Fe}}{1}>\dfrac{n_{H_2SO_4}}{1}\) nên \(Fe\) dư
\(n_{Fe(dư)}=0,75-0,25=0,5(mol)\\ \Rightarrow m_{Fe(dư)}=0,5.56=28(g)\)

\(n_{H_2}=\dfrac{4,032}{22,4}=0,18\left(mol\right)\)
PTHH: Fe + H2SO4 ---> FeSO4 + H2
0,18 <------------------------ 0,18
\(\rightarrow n_O=\dfrac{13,92-0,18.56}{16}=0,24\left(mol\right)\)
CTHH: FexOy
=> x : y = 0,18 : 0,24 = 3 : 4
CTHH Fe3O4

a, \(Fe_2O_3+3H_2\underrightarrow{t^o}2Fe+3H_2O\)
b, \(n_{Fe_2O_3}=\dfrac{24}{160}=0,15\left(mol\right)\)
Theo PT: \(n_{H_2}=3n_{Fe_2O_3}=0,45\left(mol\right)\)
\(\Rightarrow V_{H_2}=0,45.22,4=10,08\left(l\right)\)
c, n\(n_{Fe}=2n_{Fe_2O_3}=0,3\left(mol\right)\)
PT: \(Fe+2HCl\rightarrow FeCl_2+H_2\)
Theo PT: \(n_{HCl}=2n_{Fe}=0,6\left(mol\right)\Rightarrow V_{HCl}=\dfrac{0,6}{1,5}=0,4\left(M\right)\)

\(n_{Fe_3O_4}=\dfrac{24}{232}=\dfrac{3}{29}\left(mol\right)\)
PTHH :
\(Fe_3O_4+4H_2\underrightarrow{t^o}3Fe+4H_2O\)
3/29 9/29
\(Fe+2HCl\rightarrow FeCl_2+H_2\uparrow\)
9/29 18/29
\(c,V_{HCl}=\dfrac{\dfrac{18}{29}}{1,5}=\dfrac{12}{29}\left(l\right)\)

a, PT: \(Fe+H_2SO_4\rightarrow FeSO_4+H_2\)
b, Ta có: \(n_{Fe}=\dfrac{19,6}{56}=0,35\left(mol\right)\)
Theo PT: \(n_{H_2}=n_{Fe}=0,35\left(mol\right)\)
\(\Rightarrow V_{H_2}=0,35.22,4=7,84\left(l\right)\)
c, Ta có: \(n_{CuO}=\dfrac{12}{80}=0,15\left(mol\right)\)
PT: \(CuO+H_2\underrightarrow{t^o}Cu+H_2O\)
Xét tỉ lệ: \(\dfrac{0,15}{1}< \dfrac{0,35}{1}\), ta được H2 dư.
Theo PT: \(n_{H_2\left(pư\right)}=n_{CuO}=0,15\left(mol\right)\)
\(\Rightarrow n_{H_2\left(dư\right)}=0,35-0,15=0,2\left(mol\right)\)
\(\Rightarrow m_{H_2\left(dư\right)}=0,2.2=0,4\left(g\right)\)
a)\(n_{Al}=\dfrac{18}{27}=\dfrac{2}{3}mol\)
\(2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\)
\(\dfrac{2}{3}\) 1
\(V_{H_2}=1\cdot22,4=22,4l\)
b)\(n_{Fe_2O_3}=\dfrac{32}{160}=0,2mol\)
\(Fe_2O_3+3H_2\rightarrow2Fe+3H_2O\)
0,2 1 0,4 0,6
\(m_{Fe}=0,4\cdot56=22,4g\)
c)\(3Fe+2O_2\underrightarrow{t^o}Fe_3O_4\)
0,4 \(\dfrac{4}{15}\)
\(V_{O_2}=\dfrac{4}{16}\cdot22,4=\dfrac{448}{75}l\)
\(V_{kk}=5V_{O_2}=\dfrac{448}{15}l\approx29,87l\)