bài : cho 7,5 gam hỗn hợp gồm Al và Mg tác dụng với dung dịch HCl
a) hãy tính khối lượng hỗn hợp muối khan thu được sau phản ứng . biết nhôm chiếm 36% trong hỗn hợp ban đầu
b) tính thể tích hidro (đktc) thu được ở trên?
giúp e với ạ , e cảm ơn
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

mAl=36%.7,5=2,7(gam)
⇒⇒mMg=7,5-2,7=4,8(gam)
PTHH:2Al+6HCl→→3H2+2AlCl3(1)
Mg+2HCl→→H2+MgCl2(2)
Theo PTHH(1):54 gam Al tạo ra 67,2 lít H2 và 267 gam AlCl3
Vậy:2,7 gam Al tạo ra 3,36 lít H2 và 13,35 gam AlCl3
Theo PTHH(2):24 gam Mg tạo ra 22,4 lít H2 và 95 gam MgCl2
Vậy:4,8 gam Mg tạo ra 4,48 lít H2 và 19 gam MgCl2
Vậy VH2=4,48+3,36=7,84(lít)
mkhối lượng hỗn hợp thu được=13,35+19 =32,35(gam)

\(a) n_{Al} = \dfrac{7,5.36\%}{27} = 0,1(mol)\\ n_{Mg} = \dfrac{7,5-0,1.27}{24} = 0,2(mol)\\ 2Al + 6HCl \to 2AlCl_3 + 3H_2\\ Mg + 2HCl \to MgCl_2 + H_2\\ n_{AlCl_3} = n_{Al}= 0,1(mol) \Rightarrow m_{AlCl_3} = 0,1.133,5 = 13,35(gam)\\ n_{MgCl_2}= n_{Mg} = 0,2(mol) \Rightarrow m_{MgCl_2} = 0,2.95 = 19(gam)\\ b) n_{H_2} = \dfrac{3}{2}n_{Al} + n_{Mg} = 0,35(mol)\\ V_{H_2} = 0,35.22,4 = 7,84(lít)\)

mAl=36%.7,5=2,7(gam)
\(\Rightarrow\)mMg=7,5-2,7=4,8(gam)
PTHH:2Al+6HCl\(\underrightarrow{ }\)3H2+2AlCl3(1)
Mg+2HCl\(\underrightarrow{ }\)H2+MgCl2(2)
Theo PTHH(1):54 gam Al tạo ra 67,2 lít H2 và 267 gam AlCl3
Vậy:2,7 gam Al tạo ra 3,36 lít H2 và 13,35 gam AlCl3
Theo PTHH(2):24 gam Mg tạo ra 22,4 lít H2 và 95 gam MgCl2
Vậy:4,8 gam Mg tạo ra 4,48 lít H2 và 19 gam MgCl2
Vậy \(V_{H_2}=4,48+3,36=7,84\left(lít\right)\)
mkhối lượng hỗn hợp thu được=13,35+19 =32,35(gam)

Lập hệ phương trình ( Al là x , Mg là y )
\(\left\{{}\begin{matrix}27x+24y=15\\27x=\dfrac{36}{100}.15\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}x=0,2\\y=0,4\end{matrix}\right.\)
2Al + 6HCl ---> 2AlCl3 + 3H2
0,2 0,3
2Mg + 4HCl ---> 2MgCl2 + 2H2
0,4 0,4
\(\Sigma n_{H2\uparrow}=0,3+0,4=0,7\left(mol\right)\)
\(\Rightarrow V_{H2\uparrow}=0,7.22,4=15,68\left(l\right)\)

Bài 1:
\(n_{HCl}=2.0,16=0,32\left(mol\right);n_{H_2}=\dfrac{3,584}{22,4}=0,16\left(mol\right)\)
PTHH: Mg + 2HCl → MgCl2 + H2
PTHH: Fe + 2HCl → FeCl2 + H2
\(m_{H_2}=0,16.2=0,32\left(g\right)\)
\(m_{HCl}=0,32.36,5=11,68\left(g\right)\)
Theo ĐLBTKL ta có: \(m_{MgCl_2+FeCl_2}=1,4+11,68-0,32=12,76\left(g\right)\)
Bài 12:
Theo ĐLBTKL, ta có:
\(m_{hhkl}+m_{O_2}=m_{hh.oxit}\\ \Leftrightarrow11,9+m_{O_2}=18,3\\ \Leftrightarrow m_{O_2}=18,3-11,9=6,4\left(g\right)\\ n_{O_2}=\dfrac{6,4}{32}=0,2\left(mol\right)\\ V_{O_2\left(đktc\right)}=0,2.22,4=4,48\left(l\right)\)

a)
Gọi số mol Mg, Al là a, b (mol)
=> 24a + 27b = 26,25 (1)
\(n_{H_2}=\dfrac{30,8}{22,4}=1,375\left(mol\right)\)
PTHH: Mg + 2HCl --> MgCl2 + H2
a-->2a--------->a------>a
2Al + 6HCl --> 2AlCl3 + 3H2
b---->3b------->b------>1,5b
=> a + 1,5b = 1,375 (2)
(1)(2) => a = 0,25 (mol); b = 0,75 (mol)
=> \(\left\{{}\begin{matrix}\%m_{Mg}=\dfrac{0,25.24}{26,25}.100\%=22,857\%\\\%m_{Al}=\dfrac{0,75.27}{26,25}.100\%=77,143\%\end{matrix}\right.\)
b)
nHCl = 2a + 3b = 2,75 (mol)
=> mHCl = 2,75.36,5 = 100,375 (g)
=> \(m_{dd.HCl}=\dfrac{100,375.100}{10}=1003,75\left(g\right)\)
c)
mdd sau pư = 1003,75 + 26,25 - 1,375.2 = 1027,25 (g)
\(\left\{{}\begin{matrix}C\%_{MgCl_2}=\dfrac{0,25.95}{1027,25}.100\%=2,312\%\\C\%_{AlCl_3}=\dfrac{0,75.133,5}{1027,25}.100\%=9,747\%\end{matrix}\right.\)

Đáp án D
Số mol H2 thu được là : n H 2 = 11 , 2 22 , 4 = 0 , 5 mol
Gọi M là kim loại chung cho Al và Mg với hóa trị n
Sơ dồ phản ứng :
M ⏟ 10 , 2 gam + H 2 S O 4 ( l o ã n g , d ư ) → M 2 ( S O 4 ) n ⏟ m u ố i + H 2 ↑ ⏟ 0 , 5 m o l
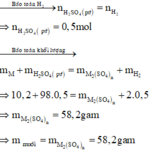
a) \(n_{Al}=\dfrac{7,5.36\%}{27}=0,1\left(mol\right)\)
\(n_{Mg}=\dfrac{7,5-0,1.27}{24}=0,2\left(mol\right)\)
PTHH: 2Al + 6HCl --> 2AlCl3 + 3H2
0,1------------>0,1----->0,15
Mg + 2HCl --> MgCl2 + H2
0,2------------>0,2----->0,2
=> mmuối = 0,1.133,5 + 0,2.95 = 32,35 (g)
b) VH2 = (0,15 + 0,2).22,4 = 7,84 (l)