đốt cháy lưu huỳnh trong bình đựng không khí thì lưu huỳnh và oxi phản ứng vừa hết .Tính khối lượng của 16,8 lít hỗn hợp khí sau khi đốt cháy lưu huỳnh nếu lưu huỳnh cháy hết oxi còn dư .Tính phần trăm các khí sau phản ứng biết 1 mol hỗn hợp khí sau phản ứng nặng 33,6 gam
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Nitơ chiếm 80% thể tích không khí, điều đó có nghĩa là trong không khí mỗi khi có 1 mol oxi sẽ có 4 mol nitơ.
S + O 2 → S O 2
Khi tạo thành 1 mol S O 2 hì hỗn hợp thu được gồm 1 mol S O 2 và 4 mol N 2
![]()
Tỉ khối của hỗn hợp đối với He là : d = 35,2/4 = 8,8

a) \(n_S=\dfrac{16}{32}=0,5\left(mol\right)\)
PTHH: S + O2 --to--> SO2
0,5->0,5------>0,5
=> mSO2 = 0,5.64 = 32 (g)
b) VO2 = 0,5.22,4 = 11,2 (l)
=> Vkk = 11,2.5 = 56 (l)
c)
\(n_{O_2}=\dfrac{24}{32}=0,75\left(mol\right)\)
Xét tỉ lệ: \(\dfrac{0,5}{1}< \dfrac{0,75}{1}\)
=> S hết, O2 dư
PTHH: S + O2 --to--> SO2
0,5->0,5------>0,5
=> nO2(dư) = 0,75 - 0,5 = 0,25 (mol)

Định luật bảo toàn khối lượng :
\(m_S+m_{O2}=m_{SO2}\)
3,2 + \(m_{O2}\) = 6,4
⇒ \(m_{O2}=6,4-3,2=3,2\left(g\right)\)
Chúc bạn học tốt
\(BTKL: \\ m_S+m_{O_2}=m_{SO_2}\\ 3,2+m_{O_2}=6,4\\ m_{O_2}=6,4-3,2=3,1(g)\)

b: \(S+O_2\rightarrow SO_2\)
\(n_{O_2}=\dfrac{V_{O_2}}{22.4}=\dfrac{5.6}{22.4}=0.25\left(mol\right)\)
\(\Leftrightarrow n_{SO_2}=0.25\left(mol\right)\)
\(V=0.25\cdot n=0.25\cdot64=16\left(lít\right)\)
\(a.PTHH:S+O_2\underrightarrow{t^o}SO_2\\ n_{O_2}=\dfrac{5,6}{22,4}=0,25\left(mol\right)\)
Từ PTHH trên ta có:
Đốt hết 1 mol S thì cần 1 mol \(O_2\)
=> Đốt hết 0,25 mol S thì cần 0,25 mol \(O_2\)
\(\Rightarrow m_S=32.0,25=8\left(g\right)\)
b. Từ PTHH trên ta có
Đốt 1 mol \(O_2\) thì sinh ra 1 mol \(SO_2\)
=> Đốt 0,25 mol \(O_2\) thì sinh ra 0,25 mol \(SO_2\)
\(\Rightarrow V_{SO_2}=22,4.0,25=5,6\left(mol\right)\)

Theo ĐLBT KL, có: mS + mO2 = mSO2
⇒ mO2 = mSO2 - mS = 96 - 48 = 48 (g)
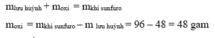
\(n_{hhkhí}=\dfrac{16,8}{22,4}=0,75\left(mol\right)\)
Gọi \(n_{SO_2}=a\left(mol\right)\left(0< a< 0,75\right)\)
\(\rightarrow n_{O_2\left(dư\right)}=0,75-b\left(mol\right)\)
Ta có: \(\dfrac{64a+32\left(0,75-a\right)}{0,75}=\dfrac{33,6}{1}=33,6\left(\dfrac{g}{mol}\right)\)
\(\rightarrow a=0,0375\left(mol\right)\)
\(\rightarrow\left\{{}\begin{matrix}\%V_{SO_2}=\dfrac{0,0375}{0,75}=5\%\\\%V_{O_2\left(dư\right)}=100\%-5\%=95\%\end{matrix}\right.\)