Câu 1. Nhỏ từ từ dung dịch chứa 0,6 mol HCl vào 300 ml dung dịch hỗn hợp Na2CO3 1,5M và NaHCO3 1M sau khi phản ứng hoàn toàn thu được V lít CO2 đktc và dung dịch X.
a. Xác định V.
b. Thêm dung dịch Ba(OH)2 dư vào dung dịch X. Tính khối lượng kết tủa thu được.
Câu 2. Cho 10,0 g hỗn hợp Cu và CuO tác dụng với 200ml dung dịch H2SO4 2M. Sau khi phản ứng kết thúc, lọc, tách riêng phần không tan, cân nặng 6,0g.
a. Tính thành phần % theo khối lượng của mỗi chất trong hỗn hợp đầu.
b. Tính nồng độ mol/lít của các chất sau phản ứng. Coi thể tích của dung dịch không thay đổi.

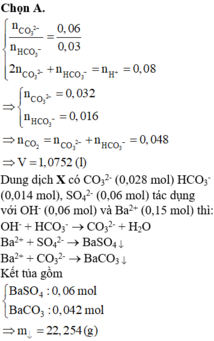

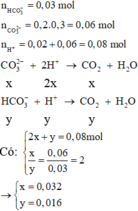
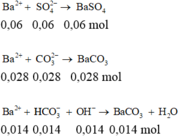
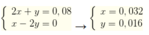
a)
\(\left\{{}\begin{matrix}n_{Na_2CO_3}=0,3.1,5=0,45\left(mol\right)\\n_{NaHCO_3}=1.0,3=0,3\left(mol\right)\end{matrix}\right.\)
PTHH: Na2CO3 + HCl --> NaCl + NaHCO3
0,45-->0,45-------------->0,45
NaHCO3 + HCl --> NaCl + CO2 + H2O
0,15<----0,15---------->0,15
=> VCO2 = 0,15.22,4 = 3,36 (l)
b)
nNaHCO3 = 0,6 (mol)
Bảo toàn C: nBaCO3 = 0,6 (mol)
=> mBaCO3 = 0,6.197 = 118,2 (g)
Câu 2
a)
\(m_{CuO\left(pư\right)}=10-6=4\left(g\right)\)
=> \(n_{CuO\left(pư\right)}=\dfrac{4}{80}=0,05\left(mol\right)\)
\(n_{H_2SO_4\left(bd\right)}=0,2.2=0,4\left(mol\right)\)
PTHH: CuO + H2SO4 --> CuSO4 + H2O
0,05--->0,05------->0,05
=> nH2SO4(pư) < nH2SO4(bd)
=> CuO tan hết
=> mCuO = 4 (g)
\(\%m_{CuO}=\dfrac{4}{10}.100\%=40\%\)
\(\%m_{Cu}=100\%-40\%=60\%\)
b) \(\left\{{}\begin{matrix}n_{CuSO_4}=0,05\left(mol\right)\\n_{H_2SO_4\left(dư\right)}=0,35\left(mol\right)\end{matrix}\right.\)
=> \(\left\{{}\begin{matrix}C_{M\left(CuSO_4\right)}=\dfrac{0,05}{0,2}=0,25M\\C_{M\left(H_2SO_4.dư\right)}=\dfrac{0,35}{0,2}=1,75M\end{matrix}\right.\)
em cmon