Bài 5: Trong PTN người ta đ/c oxit sắt từ Fe3O4 = cách dùng oxi hóa sắt ở to cao.
a) Tính số gam sắt và oxi cần dùng để điều chế được 2,32g oxi sắt từ?
b) Tính m kali pemanganat KMnO4 cần dùng để có được lượng oxi dùng cho
Bài 6. Đốt cháy 6,2g P trong một bình kín có chứa 6,72 lit khí oxi ở ĐKTC
a. Sau phản ứng P hay oxi dư , tính mP hoặc VO2 còn dư
b. Tính khối lượng hợp chất tạo thành.

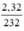 = 0,01 mol.
= 0,01 mol.
Bài 5:
a,\(n_{Fe_3O_4}=\dfrac{2,32}{232}=0,01\left(mol\right)\\ PTHH:3Fe+2O_2\underrightarrow{t^o}Fe_3O_4\)
0,03 0,02 0,01
\(\rightarrow\left\{{}\begin{matrix}m_{Fe}=0,03.56=1,68\left(g\right)\\m_{O_2}=0,02.32=0,64\left(g\right)\end{matrix}\right.\)
b, \(PTHH:2KMnO_4\underrightarrow{t^o}K_2MnO_4+MnO_2+O_2\uparrow\)
0,04 0,02
\(\rightarrow m_{KMnO_4}=0,04.158=6,32\left(g\right)\)
Bài 6:
a, \(n_P=\dfrac{6,2}{31}=0,2\left(mol\right)\\ n_{O_2}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\)
\(PTHH:4P+5O_2\underrightarrow{t^o}2P_2O_5\)
LTL: \(\dfrac{0,2}{4}< \dfrac{0,3}{5}\) => O2 dư
\(\rightarrow\left\{{}\begin{matrix}n_{O_2\left(pư\right)}=\dfrac{5}{4}n_P=\dfrac{5}{4}.0,2=0,25\left(mol\right)\\n_{P_2O_5}=\dfrac{1}{2}n_P=\dfrac{1}{2}.0,2=0,1\left(mol\right)\end{matrix}\right.\)
\(\rightarrow\left\{{}\begin{matrix}V_{O_2\left(dư\right)}=\left(0,3-0,25\right).22,4=1,12\left(l\right)\\m_{P_2O_5}=0,1.142=14,2\left(g\right)\end{matrix}\right.\)