Hoà tan 8,1g hỗn hợp Zn & ZnS bằng 250g dung dịch HCl 7,3% thu được dung dịch Y và 2,24 dm3 hỗn hợp X gồm 2 khí ở đktc.
a,Tính số gam mỗi chất trong hỗn hợp ban đầu và C% các chấtt trong dung dịch Y
b. Tính dX/H2
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a. Có các phản ứng hóa học xảy ra:
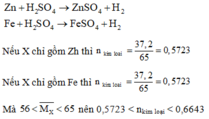
Ta có: n H 2 S O 4 phản ứng = nkim loại < 0,6643
Mà: n H 2 S O 4 ban đầu = 1 > 0,6643 nên sau phản ứng kim loại tan hết, axit còn dư.
b. Khi sử dụng lượng X gấp đôi thì 0,5723.2 < nkim loại < 0,6643.2
Hay 1,1446 < nkim loại < 1,3286
Mà nếu các kim loại bị hòa tan hết thì n H 2 S O 4 phản ứng = nkim loại > 1,1446
Do n H 2 S O 4 thực tế = 1 < 1,1446 nên sau phản ứng kim loại chưa tan hết.
Đán án A

Đáp án A
![]() .100 => mHCl = 43,78 (g)
.100 => mHCl = 43,78 (g)
nHCl = 1,2 (mol)
Gọi nZn = a, nZnO = b
Zn + 2HCl → ZnCl2 + H2
0,4 0,8 ← 0,4 (mol)
ZnO + 2HCl → ZnCl2 + H2O
0,2 ← 0,4 (mol)
![]() .100%
.100%
![]() .100% = 61,61%
.100% = 61,61%
%mZnO = 100% -61,6% = 38,4%

\(n_{N_2O}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\)
Gọi số mol Al, Zn là a, b
=> 27a + 65b = 24,9
PTHH: 8Al + 30HNO3 --> 8Al(NO3)3 + 3N2O + 15H2O
______a------------------------------>0,375a
4Zn + 10HNO3 --> 4Zn(NO3)2 + N2O + 5H2O
b-------------------------------->0,25b
=> 0,375a + 0,25b = 0,15
=> a = 0,2 ; b = 0,3
=> \(\left\{{}\begin{matrix}\%Al=\dfrac{0,2.27}{24,9}.100\%=21,69\%\\\%Zn=\dfrac{0,3.65}{24,9}.100\%=78,31\%\end{matrix}\right.\)
a)
\(n_{HCl\left(bđ\right)}=\dfrac{250.7,3\%}{36,5}=0,5\left(mol\right)\)
\(n_{khí}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\)
PTHH: Zn + 2HCl --> ZnCl2 + H2
ZnS + 2HCl --> ZnCl2 + H2S
Do nHCl(bđ) > 2.nkhí => HCl dư
Gọi số mol Zn, ZnS là a, b (mol)
=> 65a + 97b = 8,1 (1)
\(n_{khí}=n_{H_2}+n_{H_2S}=a+b=0,1\) (2)
(1)(2) => a = 0,05 (mol); b = 0,05 (mol)
\(\left\{{}\begin{matrix}m_{Zn}=0,05.65=3,25\left(g\right)\\m_{ZnS}=0,05.97=4,85\left(g\right)\end{matrix}\right.\)
nZnCl2 = 0,1 (mol) => mZnCl2 = 0,1.136 = 13,6 (g)
nHCl(dư) = 0,5 - 0,2 = 0,3 (mol) => mHCl = 0,3.36,5 = 10,95 (g)
mdd sau pư = 8,1 + 250 - 0,05.2 - 0,05.34 = 256,3 (g)
\(\left\{{}\begin{matrix}C\%_{ZnCl_2}=\dfrac{13,6}{256,3}.100\%=5,3\%\\C\%_{HCl\left(dư\right)}=\dfrac{10,95}{256,3}.100\%=4,3\%\end{matrix}\right.\)
b) \(\overline{M}_X=\dfrac{0,05.2+0,05.34}{0,05+0,05}=18\left(g/mol\right)\)
=> \(d_{X/H_2}=\dfrac{18}{2}=9\)
Ok