1.Cho 3,6 g Magie tác dụng với dung dịch loãng chứa 18,25 g axit clohidric (HCl).
a. viết phương trình phản ứng xảy ra
b. Chất nào còn dư sau phản ứng, dư bao nhiêu gam?
c. Tính thể tích hiđro thu được ở đktc?
2.
Đốt cháy hoàn toàn 6,2 gam photpho trong không khí tạo thành điphotpho pentaoxit.
a. Viết phương trình phản ứng.
b. Tính thể tích khí oxi phản ứng (đktc).
c Tính khối lượng điphotpho pentaoxit tạo thành.
d. Tính thể tích không khí cần dùng để đốt cháy.

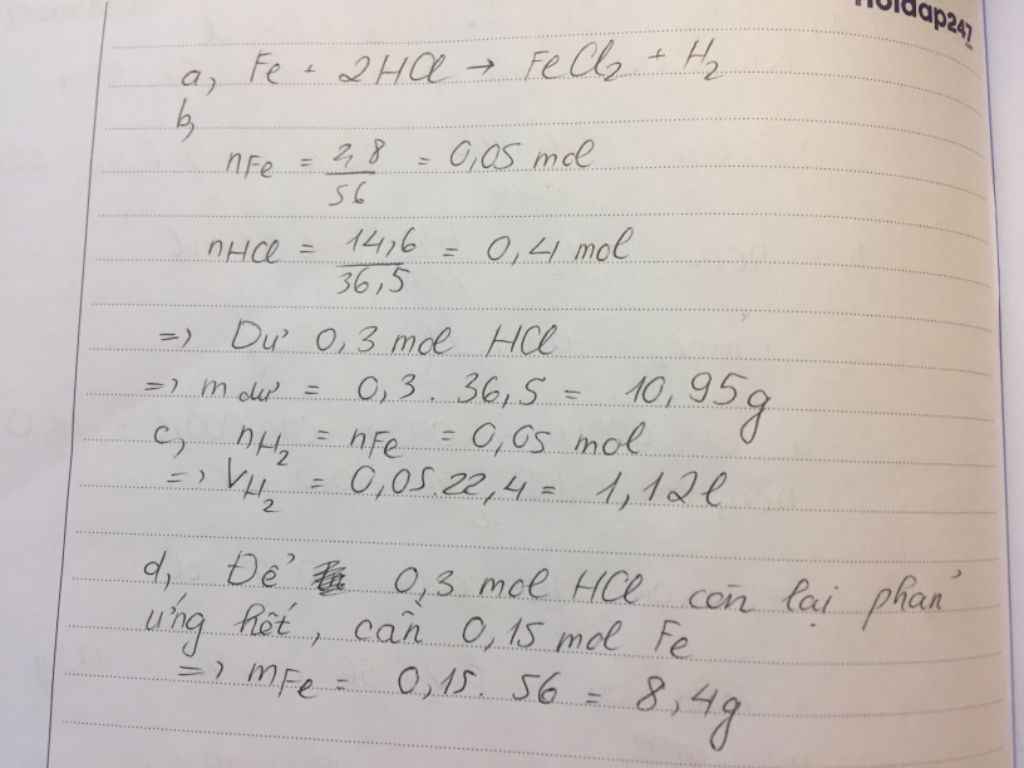
1.
a, \(n_{Mg}=\dfrac{3,6}{24}=0,15\left(mol\right);n_{HCl}=\dfrac{18,25}{36,5}=0,5\left(mol\right)\)
PTHH: Mg + 2HCl → MgCl2 + H2
Mol: 0,15 0,3
b, Ta có: \(\dfrac{0,15}{1}< \dfrac{0,5}{2}\) ⇒ Mg pứ hết, HCl dư
\(m_{HCldư}=\left(0,5-0,3\right).36,5=7,3\left(g\right)\)
c, \(V_{H_2}=0,15.22,4=3,36\left(l\right)\)
2.
a, \(n_P=\dfrac{6,2}{31}=0,2\left(mol\right)\)
PTHH: 4P + 5O2 ---to→ 2P2O5
Mol: 0,2 0,25 0,1
b, \(V_{O_2}=0,25.22,4=5,6\left(l\right)\)
c, \(m_{P_2O_5}=0,1.142=14,2\left(g\right)\)
d, \(V_{kk}=5,6.5=28\left(l\right)\)