Hòa tan hoàn toàn 10,2 gam hỗn hợp (Mg và Al) vào dung dịch H2SO4 loãng, thu được 8,96 lít khí hiđro (đktc). Khối lượng của Mg và Al lần lượt là:
A. 4,8 gam và 5,4 gam
B. 8,4 gam và 4,5 gam
C. 5,8 gam và 4,4 gam
D. 3,4 gam và 6,8 gam
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(n_{H_2}=\dfrac{11,2}{22,4}=0,5mol\)
Gọi \(\left\{{}\begin{matrix}n_{Al}=x\\n_{Mg}=y\end{matrix}\right.\)
\(2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\)
x 3/2x
\(Mg+H_2SO_4\rightarrow MgSO_4+H_2\)
y y ( mol )
Ta có:
\(\left\{{}\begin{matrix}27x+24y=10,2\\\dfrac{3}{2}x+y=0,5\end{matrix}\right.\) \(\Leftrightarrow\left\{{}\begin{matrix}x=0,2\\y=0,2\end{matrix}\right.\)
\(\Rightarrow m_{Al}=0,2.27=5,4g\)
\(\Rightarrow m_{Mg}=0,2.24=4,8g\)
=> Chọn C

2Al + 3H2SO4 →Al2(SO4)3 + 3H2 (1)
Zn + H2SO4 →ZnSO4 + H2 (2)
a;nH2=\(\dfrac{8,96}{22,4}\)=0,4(mol)
Đặt nAl=a
nZn=b
Ta có:
\(\left\{{}\begin{matrix}27x+65y=11,9\\1,5x+y=0,4\end{matrix}\right.\)
=>a=0,2;b=0,1
mAl=27.0,2=5,4(g)
%mAl=\(\dfrac{5,4}{11,9}.100\)=54,4%
%mZn=54,6%
Ta có kim loại + H2SO4 → muối + H2
nH2 = 0,4 mol
Bảo toàn nguyên tố H có nH2 = nH2SO4 = 0,4 mol
Bảo toàn khối lượng có mkim loại + mH2SO4 = mH2 + mmuối → 11,9 + 0,4.98 = 0,4.2 + m → m = 50,3

Đáp án D
Số mol H2 thu được là : n H 2 = 11 , 2 22 , 4 = 0 , 5 mol
Gọi M là kim loại chung cho Al và Mg với hóa trị n
Sơ dồ phản ứng :
M ⏟ 10 , 2 gam + H 2 S O 4 ( l o ã n g , d ư ) → M 2 ( S O 4 ) n ⏟ m u ố i + H 2 ↑ ⏟ 0 , 5 m o l
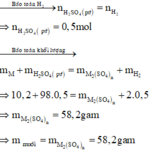

Bài 6 : Chất rắn không tan là Cu
$m_{Cu} = 6,4(gam)$
Gọi $n_{Al} = a(mol) ; n_{Mg} = b(mol) \Rightarrow 27a + 24b + 6,4 = 14,2(1)$
$2Al + 3H_2SO_4 \to Al_2(SO_4)_3 +3 H_2$
$Mg + H_2SO_4 \to MgSO_4 + H_2$
$n_{H_2} = 1,5a + b = 0,4(2)$
Từ (1)(2) suy ra a = 0,2 ; b = 0,1
$\%m_{Al} = \dfrac{0,2.27}{14,2}.100\% = 38,03\%$
$\%m_{Mg} = \dfrac{0,1.24}{14,2}.100\% =16,9\%$
$\%m_{Cu} = 100\% -38,03\% - 16,9\% = 45,07\%$
Bài 7 :
Gọi $n_{CuO} = a(mol) ; n_{ZnO} = b(mol) \Rightarrow 80a + 81b = 12,1(1)$
$CuO + 2HCl \to CuCl_2 + H_2O$
$ZnO + 2HCl \to ZnCl_2 + H_2O$
$n_{HCl} = 2a + 2b = 0,1.3 = 0,3(2)$
Từ (1)(2) suy ra a= 0,05 ; b = 0,1
$\%m_{CuO} = \dfrac{0,05.80}{12,1}.100\% = 33,06\%$
$\%m_{ZnO} = 100\% - 33,06\% = 66,94\%$

\(n_{H_2}=\dfrac{2,24}{22,4}=0,1mol\)
\(Fe+H_2SO_4\rightarrow FeSO_4+H_2\)
0,1 0,1 ( mol )
\(m_{Fe}=0,1.56=5,6g\)
\(\rightarrow m_{Cu}=10-5,6=4,4g\)
--> B
Gọi x,y lần lượt là số mol của Al, Mg
nH2 = \(\dfrac{6,72}{22,4}\)=0,3mol
Pt: 2Al + 6HCl --> 2AlCl3 + 3H2
......x.........................................1,5x
.....Mg + 2HCl --> MgCl2 + H2
......y......................................y
Ta có hệ pt:
\(\left\{{}\begin{matrix}1,5x+y=0,3\\27x+24y=10,2\end{matrix}\right.\)=> số âm xem lại