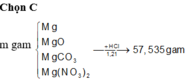
Cho hỗn hợp MgO và MgCO3 tác dụng với HCl 20% thì thu được 6,72 lít khí (đktc) và 38g muối . Tính thành phần phần trăm của MgO và MgCO3
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


a)
\(n_{MgCl_2}=\dfrac{38}{95}=0,4\left(mol\right)\)
\(n_{CO_2}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\)
PTHH: MgCO3 + 2HCl --> MgCl2 + CO2 + H2O
0,3<------0,6<------0,3<----0,3
MgO + 2HCl --> MgCl2 + H2O
0,1<---0,2<------0,1
=> \(\left\{{}\begin{matrix}m_{MgO}=0,1.40=4\left(g\right)\\m_{MgCO_3}=0,3.84=25,2\left(g\right)\end{matrix}\right.\)
b) \(m_{HCl}=\left(0,6+0,2\right).36,5=29,2\left(g\right)\)
=> \(m_{dd.HCl}=\dfrac{29,2.100}{20}=146\left(g\right)\)

MgO + 2 HCl -> MgCl2 + H2O
x______2x_____x_______x(mol)
MgCO3 + 2 HCl -> MgCl2 + CO2 + H2O
y___2y__________y______y(mol)
nMgCl2= 38/95=0,4(mol)
nCO2= 6,72/22,4= 0,3(mol)
\(\left\{{}\begin{matrix}y=0,3\\x+y=0,4\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}x=0,1\\y=0,3\end{matrix}\right.\)
=> mMgO= 40.0,1=4(g)
mMgCO3= 0,3. 84= 25,2(g)
=> \(\%mMgO=\frac{4}{4+25,2}.100\approx13,699\%\\ \rightarrow\%mMgCO3\approx100\%-13,699\%\approx86,301\%\)
\(\left\{{}\begin{matrix}MgO\\MgCO_3\end{matrix}\right.+HCl\rightarrow\left\{{}\begin{matrix}MgCl_2+H_2O\left(1\right)\\MgCl_2+H_2O+CO_2\left(2\right)\end{matrix}\right.\)
Ta có: \(n_{MgCl_2}=0,4\left(mol\right)\)
\(n_{CO_2}=0,3\left(mol\right)\)
\(\Rightarrow n_{MgCO_3}=n_{MgCl_2\left(2\right)}=0,3\left(mol\right)\)
\(\Rightarrow n_{MgO}=n_{MgCl_2\left(1\right)}=0,1\left(mol\right)\)
\(\Rightarrow\%m_{MgO}=\frac{0,1.40}{0,1.40+0,3.84}.100\%=13,99\text{%}\)
\(\%m_{MgCO_3}=86,01\%\)
Bạn than khảo nhé!

a/ \(n_{CO_2}=\dfrac{11,2}{22,4}=0,5\left(mol\right)\)
\(MgCO_3+H_2SO_4\rightarrow MgSO_4+H_2O+CO_2\)
\(0,5---0,5----0,5---0,5-0,5\)
\(MgO+H_2SO_4\rightarrow MgSO_4+H_2O\)
\(b---b----b-----b\)
\(\Rightarrow m_{MgCO_3}=0,5.\left(24+12+16.3\right)=42\left(g\right)\)
\(\dfrac{m_{MgCO_3}}{m_{MgO}}=\dfrac{7}{3}\Rightarrow m_{MgO}=42.\dfrac{3}{7}=18\left(g\right)\Rightarrow n_{MgO}=b=0,45\left(mol\right)\)
\(\Rightarrow n_{H_2SO_4}=0,45+0,5=0,95\left(mol\right)\) \(\Rightarrow m_{dd}=\dfrac{0,95.98}{0,05}=1862\left(g\right)\)

\(a.PTHH:\)
\(Mg+2HCl--->MgCl_2+H_2\uparrow\left(1\right)\)
\(MgO+2HCl--->MgCl_2+H_2O\left(2\right)\)
b. ta có: \(n_{H_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\)
Theo PT(1): \(n_{Mg}=n_{H_2}=0,2\left(mol\right)\)
\(\Rightarrow m_{MgO}=12-0,2.24=7,2\left(g\right)\)
\(\Rightarrow\%_{MgO}=\dfrac{7,2}{12}.100\%=60\%\)
c. Ta có: \(n_{hh}=0,2+\dfrac{7,2}{40}=0,38\left(mol\right)\)
Theo PT(1,2): \(n_{HCl}=2.n_{hh}=2.0,38=0,76\left(mol\right)\)
\(\Rightarrow m_{HCl}=0,76.36,5=27,74\left(g\right)\)
\(\Rightarrow m_{dd_{HCl}}=138,7\left(g\right)\)
\(\Rightarrow V_{dd_{HCl}}=126\left(ml\right)\)

\(n_{H_2}=\dfrac{2,24}{22,4}=0,1mol\)
\(Ca+2HCl\rightarrow CaCl_2+H_2\)
0,1 0,1 ( mol )
\(\rightarrow\left\{{}\begin{matrix}\%m_{Ca}=\dfrac{0,1.40}{10}.100=40\%\\\%m_{MgO}=100\%-40\%=60\%\end{matrix}\right.\)
\(\left\{{}\begin{matrix}C\%_{CaCl_2}=\dfrac{0,1.111}{10+390,2-0,1.2}.100=2,775\%\\C\%_{MgO}=\dfrac{4}{10+390,2-0,1.2}.100=1\%\end{matrix}\right.\)
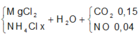


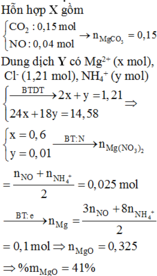
Ta có: nMgCl2=\(\dfrac{38}{95}\)=0,4(mol);
nCO2=\(\dfrac{6,72}{22,4}\)=0,3(mol)
MgCO3 + 2HCl → MgCl2 + CO2 + H2O
(mol) 0,3 ← 0,3 ← 0,3
MgO + 2HCl → MgCl2 + H2O
(mol) 0,1 ← 0,1
\(\left\{{}\begin{matrix}mMgO=0,1.40=4g\\mMgCO3=0,3.84=25,2\end{matrix}\right.\)
=>%mMgO=\(\dfrac{4}{29,2}\).100=13,7%
=>%m MgCO4=86,3%
Cho mình hỏi tại sao số mol của MgCl2 bên dưới bằng 0,1 vậy .