Trong phòng thí nghiệm, để điều chế khí hiđro người ta cho 9,45 gam kim loại nhôm tác
dụng vừa đủ với dung dịch axit sunfuric loãng H2SO4.
a) Tính khối lượng axit sunfuric cần dùng.
b) Dẫn lượng khí H2 sinh ra ở trên khử hết 36 gam bột đồng (II) oxit CuO, đun nóng. Tính thể tích khí
hiđro cần dùng (ở đktc) để khử hết khối lượng oxit bazơ nói trên?
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

nZn = 19,5 : 65= 0,3 (mol)
pthh Zn + 2HCl ---> ZnCl2 + H2
0,3--------------> 0,3-------> 0,3 (mol)
=> mZnSO4 = 0,3 . 161 ( g)
=> VH2 = 0,3 . 22,4 = 6,72 (l)
nCuO = 16 : 80 =0,2 (mol)
pthh : CuO + H2 -t--> Cu + H2O
LTL :
0,2/1 < 0,3/1
=> H2 du
ta co : nH2 (pu ) = nCuO = 0,2 (MOL)
=> nH2(d) = nH2 ( bd ) - nH2 (pu) = 0,3-0,2 = 0,1 (mol)

nZn = 19,5/65 = 0,3 (mol)
PTHH: Zn + H2SO4 -> ZnSO4 + H2
Mol: 0,3 ---> 0,3 ---> 0,3 ---> 0,3
mZnSO4 = 0,3 . 161 = 48,3 (g)
VH2 = 0,3 . 22,4 = 6,72 (l)
nCuO = 16/80 = 0,2 (mol)
PTHH: CuO + H2 -> (t°) Cu + H2O
LTL: 0,2 < 0,3 => H2 dư
nH2 (pư) = 0,2 (mol)
mH2 (dư) = (0,3 - 0,2) . 2 = 0,2 (g)


Đặt số mol hiđro sinh ra là a, ta dễ dàng tính được số mol của từng kim loại và của từng axit. Từ đó tính ra khối lượng của chúng và sẽ thấy được chỉ ở phản ứng (5) khối lượng Al và khối lượng HCl là nhỏ nhất.

2,24 lít hidro chứ chắc không phải 2,25 em hi?

a) Zn + H2SO4 --> ZnSO4 + H2
\(n_{Zn}=\dfrac{26}{65}=0,4\left(mol\right)\)
PTHH: Zn + H2SO4 --> ZnSO4 + H2
0,4-->0,4------->0,4---->0,4
=> \(m_{H_2SO_4}=0,4.98=39,2\left(g\right)\)
b) \(m_{ZnSO_4}=0,4.161=64,4\left(g\right)\)
c) \(\left\{{}\begin{matrix}m_{H_2}=0,4.2=0,8\left(g\right)\\V_{H_2}=0,4.22,4=8,96\left(l\right)\end{matrix}\right.\)
\(n_{Zn}=\dfrac{26}{65}=0,4\left(mol\right)\\
pthh:Zn+H_2SO_4\rightarrow ZnSO_4+H_2\)
0,4 0,4 0,4
\(m_{H_2SO_4}=0,8.98=78,4\left(g\right)\\
m_{ZnSO_4}=136.0,4=54,4\left(g\right)\\
m_{H_2}=0,4.2=0,6\left(g\right)\\
V_{H_2}=0,4.22,4=8,96\left(l\right)\)

![]()
Để điều chế 0,05 mol H 2 thì:
n Z n = n M g = 0,05 mol mà M M g < M Z n
⇒ Dùng Mg sẽ cần khối lượng nhỏ hơn
n H C l = 2 . n H 2 = 0,05 . 2 = 0,1 mol ⇒ m H C l = 0,1 . 36,5 = 3,65 g
n H 2 S O 4 = n H 2 = 0,05 mol ⇒ m H 2 S O 4 = 0,05 .98 = 4,9g
⇒ Dùng axit HCl sẽ cần khối lượng nhỏ hơn
Nên với những chất đã cho muốn dùng với khối lượng nhỏ nhất để điều chế H 2 ta dùng Mg và axit HCl

\(a,n_{Al}=\dfrac{10,8}{27}=0,4\left(mol\right)\\ PTHH:2Al+3H_2SO_{4\left(loãng\right)}\rightarrow Al_2\left(SO_4\right)_3+3H_2\uparrow\\ Theo.pt:n_{H_2}=\dfrac{3}{2}n_{Al}=\dfrac{3}{2}.0,4=0,6\left(mol\right)\\ b,PTHH:RO+H_2\underrightarrow{t^o}R+H_2O\\ Mol:0,6\leftarrow0,6\rightarrow0,6\\ M_R=\dfrac{38,4}{0,6}=64\left(\dfrac{g}{mol}\right)\\ \Rightarrow R.là.Cu\)

\(Zn + 2HCl \to ZnCl_2 + H_2\\ Zn + H_2SO_4 \to ZnSO_4 + H_2\\ Fe + 2HCl \to FeCl_2 + H_2\\ Fe + H_2SO_4 \to FeSO_4 + H_2\\ n_{Fe} = n_{Zn} = n_{H_2} = \dfrac{2,24}{22,4} = 0,1(mol)\\ m_{Fe} = 0,1.56 = 5,6(gam) ; m_{Zn} = 0,1.65 = 6,5(gam)\)
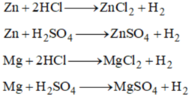
a.\(n_{Al}=\dfrac{m}{M}=\dfrac{9,45}{27}=0,35mol\)
\(2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\)
0,35 0,525 0,525 ( mol )
\(m_{H_2SO_4}=n.M=0,525.98=51,45g\)
b.\(n_{CuO}=\dfrac{m}{M}=\dfrac{36}{80}=0,45mol\)
\(CuO+H_2\rightarrow\left(t^o\right)Cu+H_2O\)
0,45 < 0,525 ( mol )
0,45 0,45 ( mol )
\(V_{H_2}=n.22,4=0,45.22,4=10,08l\)