Trộn dung dịch A chứa NaOH và dung dịch B chứa Ba(OH)2 theo tỉ lệ thể tích bằng nhau thu được dung dịch C. Trung hoà 100 ml dung dịch C cần dùng hết 35 ml dung dịch H2SO4 2M và thu được 9,32 gam kết tủa. Tính nồng độ mol của các dung dịch A và B. Cần phải trộn bao nhiêu ml dung dịch B với 20 ml dung dịch A để thu được dung dịch D có thể hoà tan vừa hết 20,4 gam bột Al2O3
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

A: H2SO4 : CA (M)
B1: NaOH : C1 (M)
B2: NaOH: C2 (M)
TH1: VB1: VB2 = 1: 1 => gọi thể tích của mỗi chất là V
Nồng độ của NaOH sau khi trộn là: CM = n : V
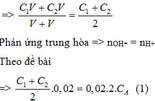
TH2: VB1 : VB2 = 2 : 1 => Đặt VB2 = V (lít) thì VB1 = 2V (lít)
Nồng độ của NaOH sau khi trộn là:

Ta có:
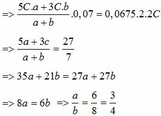

Chọn đáp án B
n H C l =1 V A ; n H N O 3 = 1 V A ; n H 2 S O 4 =1 V A → n H + =4 V A
n K O H = 1 V A ; n N a O H = 2 V B → n O H - = 3 V B
Để thu được dung dịch có pH= 7 thì n H + = n O H -
→ 4 V A = 3 V B → V A : V B = 3 : 4

Đáp án : A
dd X : nH+ = 2nH2SO4 + nHCl = 0,02 mol
dd Y : nOH = nNaOH + 2nBa(OH)2 = 0,04 mol
=> Trong Y : nOH – nH+ = 0,02 mol = nOH- => COH = 0,1M => pH = 13
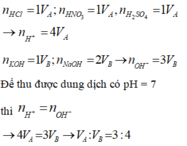
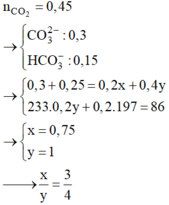
Gọi \(\left\{{}\begin{matrix}C_{M\left(A\right)}=aM\\C_{M\left(B\right)}=bM\end{matrix}\right.\)
Giả sử trộn 50ml dd A với 50ml dd B để thu được 100ml dd C
=> \(\left\{{}\begin{matrix}n_{NaOH}=0,05a\left(mol\right)\\n_{Ba\left(OH\right)_2}=0,05b\left(mol\right)\end{matrix}\right.\)
\(n_{BaSO_4}=\dfrac{9,32}{233}=0,04\left(mol\right)\)
nH2SO4 = 0,035.2 = 0,07 (mol)
PTHH: Ba(OH)2 + H2SO4 --> BaSO4 + 2H2O
0,04<----0,04<-------0,04
2NaOH + H2SO4 --> Na2SO4 + 2H2O
0,06<----0,03
=> \(\left\{{}\begin{matrix}0,05a=0,06\\0,05b=0,04\end{matrix}\right.\)
=> a = 1,2; b = 0,8
20 ml dd A chứa nNaOH = 0,02.1,2 = 0,024 (mol)
\(n_{Al_2O_3}=\dfrac{20,4}{102}=0,2\left(mol\right)\)
PTHH: 2NaOH + Al2O3 --> 2NaAlO2 + H2O
0,024-->0,012
Ba(OH)2 + Al2O3 --> Ba(AlO2)2 + H2O
0,188<---0,188
=> \(V_{dd.B}=\dfrac{0,188}{0,8}=0,235\left(l\right)=235\left(ml\right)\)