Baì 6: Trong PTN có thể điều chế khí hiđro bằng cách cho các kim loại : Sắt, Kẽm , Nhôm phản ứng với dd axit Clohidric. a-Nếu lấy cùng một khối lượng mỗi kim loại trên thì khí hiđro điều chế được với kim loaị nào là nhiều nhất.? b-Nếu muốn điều chế cùng một lượng khí hiđro thì dùng kim loại nào tiết kiệm kim loại nhất?
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Đặt số mol hiđro sinh ra là a, ta dễ dàng tính được số mol của từng kim loại và của từng axit. Từ đó tính ra khối lượng của chúng và sẽ thấy được chỉ ở phản ứng (5) khối lượng Al và khối lượng HCl là nhỏ nhất.

a) Phương trình phản ứng:
Zn + H2SO4 → ZnSO4 + H2
Fe + H2SO4loãng → FeSO4 + H2
2Al+ 3H2SO4 → Al2(SO4)3 + 3H2
b) Giả sử cho cùng một khối lượng là a g kim loại kẽm sắt và nhôm
Zn + H2SO4 → ZnSO4 + H2 (1)
Fe + H2SO4loãng → FeSO4 + H2 (2)
2Al+ 3H2SO4 → Al2(SO4)3 + 3H2 (3)
Ta có 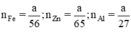
Theo pt nH2 (1) = nZn = 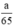 mol
mol
nH2 (2) = nFe = 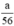 mol
mol
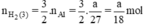
Như vậy ta nhận thấy 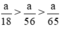 ⇒ nH2 (3) > nH2 (2) > nH2 (1)
⇒ nH2 (3) > nH2 (2) > nH2 (1)
Như vậy cho cùng một lượng kim loại tác dụng với axit H2SO4 loãng dư thì nhôm cho nhiều khí hidro hơn, sau đó đến sắt và ít nhất là kẽm
c) Nếu thu được cùng một lượng khí hidro thì khối lượng kim loại ít nhất là nhôm, sau đó đến sắt, cuối cùng là kẽm.

a)
\(Zn+H2SO4\rightarrow ZnSO4+H2\)
\(2Al+3H2SO4\rightarrow Al2\left(SO4\right)3+3H2\)
\(Fe+H2SO4\rightarrow FeSO4+H2\)
b) giải sử khối KL cùng là \(m\left(g\right)\)
\(\Rightarrow n_{Zn}=\frac{m}{65}\Rightarrow n_{H_2}=\frac{m}{65}\)
\(\Rightarrow n_{Al}=\frac{m}{27}\Rightarrow n_{H_2}=1,5.\frac{m}{27}\)
\(\Rightarrow n_{Fe}=\frac{m}{56}\Rightarrow n_{H_2}=\frac{m}{56}\)
\(\Rightarrow Al\)
c) Giả sử : \(n_{H_2}=0,15mol\)
\(\Rightarrow n_{Zn}=0,15mol\Rightarrow m=9,75g\)
\(\Rightarrow n_{Al}=0,1mol\Rightarrow m=2,7g\)
\(\Rightarrow n_{Fe}=0,15mol\Rightarrow m=8,4g\)
\(\Rightarrow Al\)

a, PT: \(Mg+2HCl\rightarrow MgCl_2+H_2\)
\(Zn+2HCl\rightarrow ZnCl_2+H_2\)
b, Coi mMg = mZn = 1 (g)
Ta có: \(n_{H_2\left(Mg\right)}=n_{Mg}=\dfrac{1}{24}\left(mol\right)\)
\(n_{H_2\left(Zn\right)}=n_{Zn}=\dfrac{1}{65}\left(mol\right)\)
\(\Rightarrow\dfrac{1}{24}>\dfrac{1}{65}\)
Vậy: Mg cho nhiều khí H2 hơn.

a, nZn = 97,5/65 = 1,5 (mol)
PTHH: Zn + 2HCl -> ZnCl2 + H2
nH2 = nZn = 1,5 (mol)
VH2 = 1,5 . 22,4 = 33,6 (l)
b, nFe2O3 = 120/160 = 0,75 (mol)
PTHH: Fe2O3 + 3H2 -> (t°) 2Fe + 3H2O
LTL: 0,75 > 1,5/3 => Fe2O3 dư
nFe2O3 (p/ư) = 1,5/3 = 0,5 (mol)
mFe2O3 (dư) = (0,75 - 0,5) . 160 = 40 (g)
a. \(n_{Zn}=\dfrac{97.5}{65}=1,5\left(mol\right)\)
PTHH : Zn + 2HCl -> ZnCl2 + H2
1,5 1,5
b. \(V_{H_2}=1,5.22,4=33,6\left(l\right)\)
c. \(n_{Fe_2O_3}=\dfrac{120}{160}=0,75\left(mol\right)\)
PTHH : Fe2O3 + 3H2 -> 2Fe + 3H2O
0,5 1,5
Ta thấy \(\dfrac{0.75}{1}>\dfrac{1.5}{3}\) => Fe2O3 dư
\(m_{Fe_2O_3\left(dư\right)}=\left(0,75-0,5\right).160=40\left(g\right)\)
\(V_{Fe_2O_3\left(dư\right)}=0,5.22,4=11,2\left(l\right)\)

a) giả sử lấy ở mỗi KL 1 mol tác dụng vs HCl
Fe+2HCl---->.FeCl2+H2
1--------------------------1(mol)
Zn+2HCl-->FeCl2+H2
1------------------------1(mol)
2Al+6HCl-->2AlCl3+3H2
1----------------------------1,5(mol)
----> Al thu dc nhiều khí H2 hơn
b) giả sử số mol khí H2 cần thu là 1 mol
1--------------------------1(mol)
Zn+2HCl-->FeCl2+H2
1------------------------1(mol)
2Al+6HCl-->2AlCl3+3H2
0,667----------------------------1(mol)
--> Al tiết kiệm nhất

giả sử 2 kim loại cùng 1 khối lượng là a , ta có
\(2Al+6HCl->2AlCl_3+3H_2\)
(mol) \(\frac{a}{27}\) \(\frac{a}{18}\)
\(Fe+2HCl->FeCl_2+H_2\)
(mol) \(\frac{a}{56}\) \(\frac{a}{56}\)
vì \(\frac{a}{56}< \frac{a}{18}\) => cùng 1 khối lượng như nhau , Al cho thể tích khí hidro nhiều hơn Fe

- pt: Zn + 2HCl -> ZnCl2 +H2
- nHCl = ( 3,25 : 65 ) x 2 = 0,1 (mol)
V = 0,1 : 0,5 = 0,2 (l)
- gọi a là số mol cần tìm
- pt: 2Al + 3H2SO4 -> Al2(SO4)3 + 3H2
a -> 3/2a
Fe + H2SO4 -> FeSO4 + H2
a -> a
- ta có : a + 3/2a = 0,05 => a = 0,02 (mol)
- C%Fe = ( 0,02 x 56)x100 / (0,02x56 + 0,02x 27) = 67,47%
- C% Al = 100 -67,47= 32,53%

Phương trình hóa học của phản ứng:
Fe + H2SO4 → FeSO4 + H2.
Zn + H2SO4 → ZnSO4 + H2.
Fe + 2HCl → FeCl2 + H2.
Zn + 2HCl → ZnCl2 + H2.
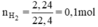
Theo phương trình (3) mFe cần dùng: 56.0,1 = 5,6g.
Theo phương trình (4) mZn cần dùng: 65.0,1 = 6,5g.

Fe + 2HCl → FeCl2 + H2
Zn + 2HCl → ZnCl2 + H2
2Al + 6HCl → 2AlCl3 + 3H2
a) Đặt khối lượng của ba kim loại là 1 gam
→ nFe = 1/56 mol, nZn = 1/65 mol, nAl = 1/27 mol
→ Số mol H2 do sắt tạo thành: nH2 (1) = 1/56 mol
Số mol H2 do kẽm tạo thành: nH2 (2) = 1/65 mol
Số mol H2 do nhôm tạo thành: nH2 (3) = 1/18 mol
→ Số mol H2 (2) < (1) < (3)
→ Nếu lấy cùng khối lượng mỗi kim loại trên thì nhôm có thể tạo ra nhiều khí nhất.
b) Đặt số mol khí H2 tạo thành là 1 mol
→ nFe = 1 mol → m Fe = 56 gam
nZn = 1 mol → mZn = 65 gam
nAl = 2/3 mol → mAl = 18 gam
→ Để tạo thành được 1 mol khí H2 thì dùng Al sẽ tốn ít kim loại nhất