Cho 10,3 gam hỗn hợp Cu, Al, Fe vào dung dịch HCl 2M lấy dư, sau phản ứng thuđược 5,6 lít khí (đktc) và 2 gam chất rắn không tan. Tính % theo khối lượng từng chất trong hỗn hợp banđầu và thể tích HCl tham gia phản ứng
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án D
Chất rắn Y là Cu không phản ứng
![]() = 0,25
= 0,25
2Al + 6HCl → 2AlCl3 + 3H2
a 1,5a (mol)
Fe + 2HCl→ FeCl2 + H2
b b (mol)
Ta có:
27a + 56b = 8,3
1,5a + b = 0,25
=> a = b = 0,1 (mol)
![]() .100 = 19,4%
.100 = 19,4%
![]() .100 = 54,3%
.100 = 54,3%

\(m_{không.tan}=m_{Cu}=2\left(g\right)\\ \Rightarrow m_{Al,Fe}=10,3-2=8,3\left(g\right)\\ Đặt:a=n_{Al}\left(mol\right);b=n_{Fe}\left(mol\right)\left(a,b>0\right)\\ PTHH:2Al+6HCl\rightarrow2AlCl_3+3H_2\\ Fe+2HCl\rightarrow FeCl_2+H_2\\ \Rightarrow\left\{{}\begin{matrix}27a+56b=8,3\\1,5.22,4a+22,4b=5,6\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}a=0,1\\b=0,1\end{matrix}\right.\\ \Rightarrow\%m_{Cu}=\dfrac{2}{10,3}.100\approx19,417\%\\ \%m_{Fe}=\dfrac{56.0,1}{10,3}.100\approx54,369\%\\ \Rightarrow\%m_{Al}\approx26,214\%\)

2Al + 6HCl → 2 A l C l 3 + 3 H 2
a……….3/2.a (mol)
Mg + 2HCl → M g C l 2 + H 2
b....................b (mol)
4 gam rắn không tan là Cu, gọi số mol của Al và Mg lần lượt là a và b (mol). Ta có:
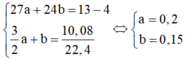
⇒ % m C u = 4 13 .100 = 30,77 % ⇒ % m A l = 0,2.27 13 .100 = 41,54 % ⇒ % m M g = 100 % − 30,77 % − 41,54 % = 27,69 %
⇒ Chọn C.

So sánh các phản ứng của hỗn hợp X với oxi và hỗn hợp Y với dung dịch HCl, ta thấy :
n HCl = 2 n trong oxit ; m O 2 = 8,7 - 6,7 = 2g
n O trong oxit = 0,125 mol; n HCl = 0,25 mol
V HCl = 0,25/2 = 0,125l

\(n_{Fe} = a(mol) ; n_{Mg} = b(mol)\\ \Rightarrow 56a + 24b = 16,8 - 6,4 = 10,4(1)\\ Fe + 2HCl \to FeCl_2 + H_2\\ Mg + 2HCl \to MgCl_2 + H_2\\ n_{H_2} = a + b = \dfrac{6,72}{22,4} = 0,3(2)\)
Từ (1)(2) suy ra: a = 0,1 ; b = 0,2
Vậy :
\(\%m_{Fe} = \dfrac{0,1.56}{16,8}.100\% = 33,33\%\\ \%m_{Mg} = \dfrac{0,2.24}{16,8}.100\% = 28,57\%\\ \%m_{Cu} = 100\% - 33,33\% - 28,57\% = 38,1\%\)

Chọn C.
Hỗn hợp X gồm Al và Fe với số mol mỗi chất bằng 0,2 mol
Hỗn hợp Y gồm Cu(NO3)2 (0,2x mol) và AgNO3 (0,2y mol)
Hỗn hợp Z gồm Ag, Cu và Fe dư Þ nFe dư = 0,1 mol và 64.0,2x + 108.0,2y = 40,8 (1)
→ BT : e 0 , 2 . 3 + 2 . ( 0 , 2 - 0 , 1 ) = 0 , 2 x . 2 + 0 , 2 y (2). Từ (1), (2) suy ra: x = 1,5

Chọn C.
Hỗn hợp X gồm Al và Fe với số mol mỗi chất bằng 0,2 mol
Hỗn hợp Y gồm Cu(NO3)2 (0,2x mol) và AgNO3 (0,2y mol)
Hỗn hợp Z gồm Ag, Cu và Fe dư Þ nFe dư = 0,1 mol và 64.0,2x + 108.0,2y = 40,8 (1)
→ B T : e 0 , 2 . 3 + 2 . 0 , 2 - 0 , 1 = 0 , 2 x . 2 + 0 , 2 y 2
Từ (1), (2) suy ra: x = 1,5

\(a) m_{Cu} = 9,6(gam)\\ n_{Al} = a(mol) ; n_{Fe} = b(mol)\\ \Rightarrow 27a + 56b = 16,55 -9,6 =6,95(1)\\ 2Al + 6HCl \to 2AlCl_3 + 3H_2\\ Fe + 2HCl \to FeCl_2 + H_2\\ n_{H_2} = 1,5a + b = \dfrac{3,92}{22,4} = 0,175(2)\\ (1)(2) \Rightarrow a = 0,05 ; b = 0,1\\ m_{Al} = 0,05.27 = 1,35(gam); n_{Fe} = 0,1.56 = 5,6(gam)\)
\(b) n_{HCl} = 2n_{H_2} = 0,175.2 = 0,35(mol) \Rightarrow m_{HCl} = 0,35.36,5 = 12,775(gam)\)

Gọi số mol Al, Fe là a, b
\(m_{Cu}=m_B=6,4\left(g\right)\)
=> \(m_{Al}+m_{Fe}=17,4-6,4=11\left(g\right)\)
=> 27a + 56b = 11
\(n_{H_2}=\dfrac{8,96}{22,4}=0,4\left(mol\right)\)
PTHH: Fe + 2HCl --> FeCl2 + H2
b----------------------->b
2Al + 6HCl --> 2AlCl3 + 3H2
a------------------------>1,5a
=> 1,5a + b = 0,4
=> a = 0,2; b = 0,1
=> \(\left\{{}\begin{matrix}m_{Fe}=0,1.56=5,6\left(g\right)\\m_{Al}=0,2.27=5,4\left(g\right)\end{matrix}\right.\)
mCu = 2 (g)
Gọi số mol Al, Fe là a, b (mol)
=> 27a + 56b = 10,3 - 2 = 8,3 (1)
\(n_{H_2}=\dfrac{5,6}{22,4}=0,25\left(mol\right)\)
PTHH: 2Al + 6HCl --> 2AlCl3 + 3H2
a--------------------->1,5a
Fe + 2HCl --> FeCl2 + H2
b---------------------->b
=> 1,5a + b = 0,25 (2)
(1)(2) => a = 0,1 (mol); b = 0,1 (mol)
=> \(\left\{{}\begin{matrix}\%Al=\dfrac{0,1.27}{10,3}.100\%=26,21\%\\\%Fe=\dfrac{0,1.56}{10,3}.100\%=54,37\%\\\%Cu=\dfrac{2}{10,3}.100\%=19,42\%\end{matrix}\right.\)
\(n_{HCl}=2.n_{H_2}=0,5\left(mol\right)\)
=> \(V_{dd.HCl}=\dfrac{0,5}{2}=0,25\left(l\right)\)