Hòa tan hoàn toàn 2.7 gam một kim loại A nhóm IIIA vào 200ml HCl vừa đủ thu được dung dịch X và 3,36 lít khí (đktc). Xác định tên kim loại A và nồng độ mol/l dung dịch X. Giúp mình với ạ cám mơn nhiều
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


2A+6HCl->2ACl3+3H2
0,2----0,6------------0,3 mol
n H2=\(\dfrac{6,72}{22,4}\)=0,3 mol
=>\(\dfrac{5,4}{A}\)=0,2
=>A=27 g\mol
=>A là nhôm (Al)
CMHCl=\(\dfrac{0,6}{0,5}\)=1,2M
\(5,4gA+500mlHCl->X:ACl3+6,72lH2\)
nH2 = 0,3 ( mol )
=> nAl = 2/3.nH2 = 0,2 ( mol )
( Cân bằng PTHH )
Ta có :
M = \(\dfrac{5,4}{0,2}=27\left(\dfrac{g}{mol}\right)\)
=> Đó là Al

\(n_{H_2}=\dfrac{1,12}{22,4}=0,05\left(mol\right)\)
PTHH: 2A + 2H2O --> 2AOH + H2
0,1<------------0,1<--0,05
=> \(M_A=\dfrac{2,3}{0,1}=23\left(g/mol\right)\)
=> A là Na (Natri)
\(C_{M\left(ddNaOH\right)}=\dfrac{0,1}{0,2}=0,5M\)

\(n_{H_2}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\)
PTHH: 2A + 2H2O --> 2AOH + H2
0,2<-------------0,2<----0,1
=> \(M_A=\dfrac{7,8}{0,2}=39\left(g/mol\right)\)
=> A là Kali (K)
nKOH = 0,2 (mol)
=> \(C_{M\left(X\right)}=\dfrac{0,2}{0,2}=1M\)

a) \(n_{H_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\)
PTHH: A + 2H2O --> A(OH)2 + H2
0,2<--------------0,2<-----0,2
=> \(M_A=\dfrac{8}{0,2}=40\left(g/mol\right)\)
=> A là Ca (Canxi)
b) \(C_M=\dfrac{0,2}{0,5}=0,4M\)

Bài 3 :
\(3,040Fe;Cu+HNO3\left(l\right)->\left\{{}\begin{matrix}Fe\left(NO3\right)3\\Cu\left(NO3\right)2\end{matrix}\right.+0,896\left(l\right)NO\)
Gọi Fe là x , Cu là y
Ta có :
nNO = 0,04 ( mol )
Feo - 3e -> Fe+3
x 3x
Cuo - 2e -> Cu+2
y 2y
N+5 + 3e -> N+2
0,12 <- 0,04
n(e) cho = n(e) nhận
Ta có hpt :
\(\left\{{}\begin{matrix}56x+64y=3,040\\3x+2y=0,12\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}x=0,02\left(mol\right)\\y=0,03\left(mol\right)\end{matrix}\right.\)
Xác đinh phần trăm khối lượng trong kim loại :
\(\left\{{}\begin{matrix}\%mFe=\dfrac{56.0,02}{3,04}=36,84\%\\\%mCu=\dfrac{64.0,03}{3,04}=63,15\%\end{matrix}\right.\)

\(n_{H_2}=\dfrac{5.6}{22.4}=0.25\left(mol\right)\)
\(M+2H_2O\rightarrow M\left(OH\right)_2+H_2\)
\(0.25................0.25............0.25\)
\(M_A=\dfrac{10}{0.25}=40\left(\dfrac{g}{mol}\right)\)
\(A:Ca\)
\(C_{M_{Ca\left(OH\right)_2}}=\dfrac{0.25}{0.5}=0.5\left(M\right)\)


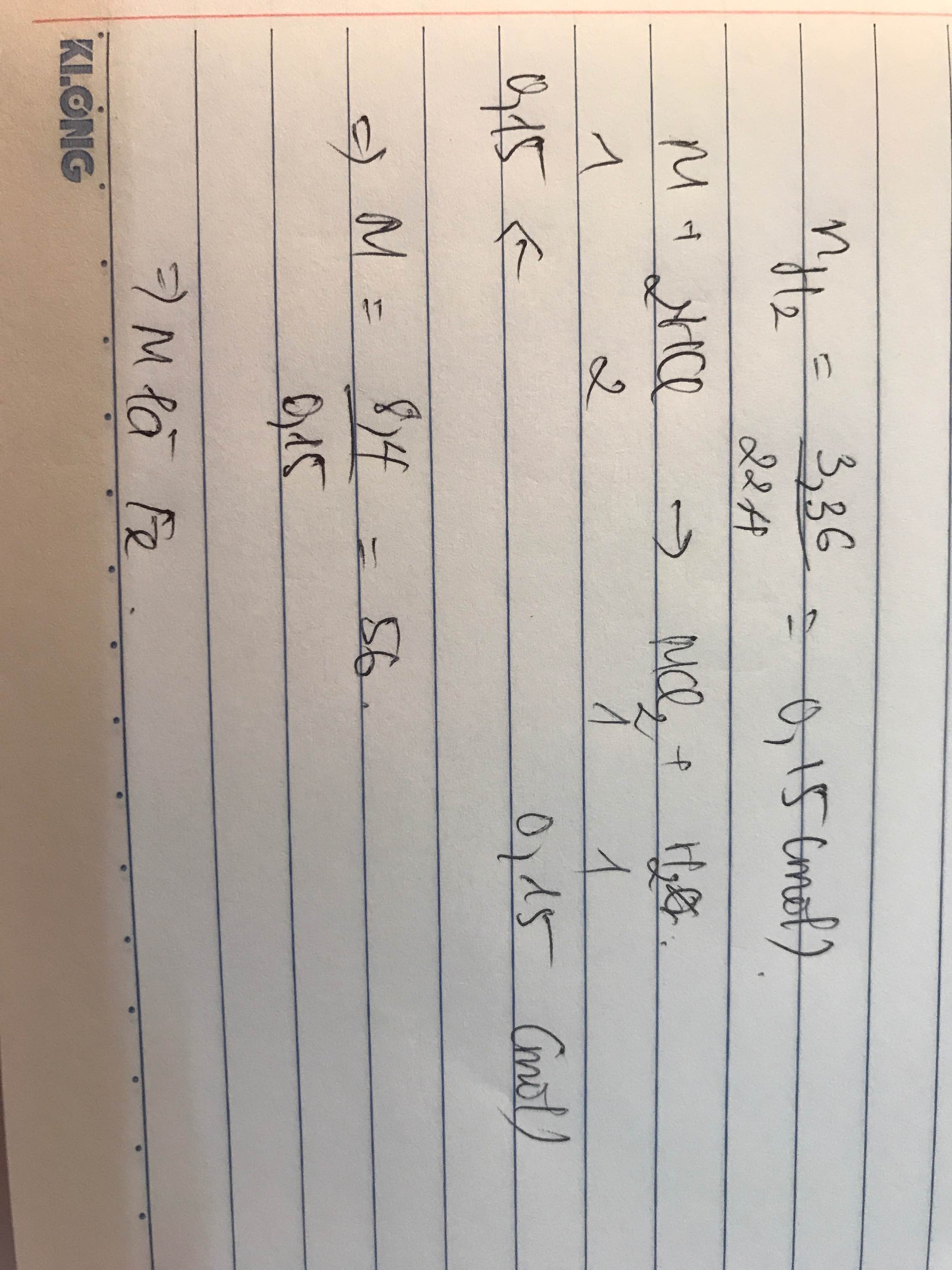
nH2 = 3,36/22,4 = 0,15 (mol)
PTHH: 2R + 6HCl -> 2RCl3 + 3H2
nR = nRCl3 = 0,15 : 2/3 = 0,1 (mol)
M(R) = 2,7/0,1 = 27 (g/mol)
=> R là Al
CMAlCl3 = 0,1/0,2 = 0,5M
Ta có :
2Al + 6HCl ---> 2ACl3 + 3H2
nH2 = 0,15 mol
=> nAl = 0,1 mol
=> M = 2,7/0,1 = 27
=> ĐÓ là Al
nACl3 = 2/3nH2 = 0,1 mol
Cm = n/V = 0,1 / 0,2 = 0,5M