Câu 1: Cần thu được 4 Lọ oxi ,mỗi lọ có dung tích 200 ml cần dùng bao nhiêu gam Kali pemanganat, biết O2 hao hụt 15% (các thể tích đó ở đktc)? Câu 2: chốt cháy 6,2(g) photpho trong bình có dung tích 44,8(l) (đktc) . Hỏi P cháy hết không ? Vì sao?
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Bài 6:
PTHH: \(2H_2+O_2\underrightarrow{t^o}2H_2O\)
Ta có: \(\left\{{}\begin{matrix}n_{H_2}=\dfrac{8,4}{22,4}=0,375\left(mol\right)\\n_{O_2}=\dfrac{2,8}{22,4}=0,125\left(mol\right)\end{matrix}\right.\)
Xét tỉ lệ: \(\dfrac{0,375}{2}>\dfrac{0,125}{1}\) \(\Rightarrow\) H2 còn dư, O2 p/ứ hết
\(\Rightarrow n_{H_2O}=0,25\left(mol\right)\) \(\Rightarrow m_{H_2O}=0,25\cdot18=4,5\left(g\right)\)

a) \(V_{O_2}=20.0,1=2\left(l\right)\)
=> \(n_{O_2}=\dfrac{2}{22,4}=\dfrac{5}{56}\left(mol\right)\)
=> nO2(PTHH) = \(\dfrac{5}{56}:90\%=0,1\left(mol\right)\)
PTHH: 2KMnO4 --to--> K2MnO4 + MnO2 + O2
0,2<------------------------------0,1
=> \(m_{KMnO_4}=0,2.158=31,6\left(g\right)\)
b)
PTHH: \(2KClO_3\xrightarrow[MnO_2]{t^o}2KCl+3O_2\)
\(\dfrac{1}{15}\)<--------------------0,1
=> \(m_{KClO_3}=\dfrac{1}{15}.122,5=8,167\left(g\right)\)

a) Do khí oxi thu được hao hụt 10% nên hiệu suất phản ứng là 90%.
Thể tích khí oxi thu được là:
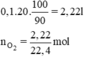
Phương trình hóa học của phản ứng nhiệt phân KMnO4:
2KMnO4 -to→ O2 + K2MnO4 + MnO2.
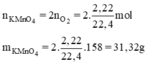
b) Ý b) tách biệt so với ý a), ngoài ra ở ý b) không cho lượng oxi hao hụt là bao nhiêu nên ta lấy hiệu suất phản ứng đạt 100%.
Thể tích khí oxi thu được là: V = 0,1.20 = 2 (lít)


a, Thể tích khí oxi cần thu là: 20*100 = 2000(ml) = 2(l).
Vì hao hụt 10% nên thể tích khí oxi cần có là: 100*2/90 = 20/9 (l).
Số mol khí oxi là: 20/(22,4*9) = 0,099 (mol)
2KMnO4 => K2MnO4 + MnO2 + O2
Số mol KMnO4 là: 0,099 * 2 = 0,2 (mol)
Khối lượng KMnO4 là: 0,2*158 = 31,3 (g)
b, 2KClO3 => 2KCl + 3O2
Số mol KClO3 là: 0,099*2/3 = 0,066 (mol).
Khối lượng cần dùng là: 0,066*122,5 = 8,085 (g)
2 PTPU trên đều có nhiệt độ

\(V_{H_2}=10.0,2=2\left(l\right)\)
=> \(n_{H_2\left(thu.đc\right)}=\dfrac{2}{22,4}=\dfrac{5}{56}\left(mol\right)\) => \(n_{H_2\left(sinh.ra\right)}=\dfrac{5}{56}:85\%=\dfrac{25}{238}\left(mol\right)\)
PTHH: Zn + 2HCl --> ZnCl2 + H2
\(\dfrac{25}{238}\)<--\(\dfrac{25}{119}\)<---------\(\dfrac{25}{238}\)
=> \(m_{Zn}=\dfrac{25}{238}.65=\dfrac{1625}{238}\left(g\right)\)
\(m_{HCl}=\dfrac{25}{119}.36,5=\dfrac{1825}{238}\left(g\right)\)

a, Thể tích khí oxi cần thu là: 20*100 = 2000(ml) = 2(l).
Vì hao hụt 10% nên thể tích khí oxi cần có là: 100*2/90 = 20/9 (l).
Số mol khí oxi là: 20/(22,4*9) = 0,099 (mol)
2KMnO4 => K2MnO4 + MnO2 + O2
Số mol KMnO4 là: 0,099 * 2 = 0,2 (mol)
Khối lượng KMnO4 là: 0,2*158 = 31,3 (g)
b, 2KClO3 => 2KCl + 3O2
Số mol KClO3 là: 0,099*2/3 = 0,066 (mol).
Khối lượng cần dùng là: 0,066*122,5 = 8,085 (g)
Hihi

a) \(V_{O_2\left(thu.được\right)}=20.0,1=2\left(l\right)\)
=> \(V_{O_2\left(sinh.ra\right)}=\dfrac{2.100}{90}=\dfrac{20}{9}\left(l\right)\)
=> \(n_{O_2\left(sinh.ra\right)}=\dfrac{\dfrac{20}{9}}{22,4}=\dfrac{25}{252}\left(mol\right)\)
PTHH: 2KMnO4 --to--> K2MnO4 + MnO2 + O2
\(\dfrac{25}{126}\)<----------------------------\(\dfrac{25}{252}\)
=> \(m_{KMnO_4}=\dfrac{25}{126}.158=\dfrac{1975}{63}\left(g\right)\)
b)
PTHH: 2KClO3 --to,MnO2--> 2KCl + 3O2
\(\dfrac{25}{378}\)<---------------------\(\dfrac{25}{252}\)
=> \(m_{KClO_3}=\dfrac{25}{378}.122,5=\dfrac{875}{108}\left(g\right)\)
câu1
n O2=4.0,2=0,8 mol
2KMnO4-to>K2MnO4+MnO2+O2
1,6------------------------------------0,8 mol
=>m KMnO4=1,6.158=252,8g
mà hao hụt 15%
=>m KMnO4=252,8.\(\dfrac{115}{100}\)=290,72g
bài 2
4P+5O2-to>2P2O5
n P=\(\dfrac{6,2}{31}\)=0,2 mol
n O2=\(\dfrac{44,8}{22,4}\)=2 mol
=>P cháy hết
vì theo tính toán thấy số oxi có số mol dư rất nhiều hơn P
\(\dfrac{0,2}{4}< \dfrac{2}{5}\)