Biết rằng 0,1 lít khí etilen (đktc) làm mất màu tối đa 50 ml dung dịch brom. Nếu dùng 0,1 lít khí axetilen (đktc) thì có thể làm mất màu tối đa thể tích dung dịch brom trên là
A. 200 ml
B. 150 ml
C. 100 ml
D. 50 ml
Cho em xin lời giải cụ thể ạ
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Lời giải:
CH2=CH2 + Br2 → C2H4Br2 (1)
P.ư: →
(mol)
HC=CH + 2Br2 → Br2CH-CHBr2 (2)
P.ư: → 2.
(mol)
Từ (1) và (2) ta thấy số mol Br2 phản ứng với C2H2 gấp 2 lần số mol Br2 phản ứng với C2H4
Vì cùng một dung dịch brom nên thể tích dung dịch brom cần là 50 x 2 = l00ml.
Giải:
Ta có:\(n_{C_2H_4}=\dfrac{0.1}{22,4}=\dfrac{1}{224}\left(mol\right)\)
\(C_2H_4\) + Br2 → C2H4Br2 (1)
\(\dfrac{1}{224}mol:\dfrac{1}{224}mol\) \(C_2H_2\) + 2Br2 → \(C_2H_2Br_4\) (2) \(\dfrac{1}{224}mol:\dfrac{2}{224}mol\) Từ (1)(2):ta thấysố mol Br2 phản ứng với C2H2 gấp 2 lần số mol Br2 phản ứng với C2H4
Vì cùng một dung dịch brom nên thể tích dung dịch brom cần là 50 x 2 = 100ml.

Ta có: \(n_{Br_2}=0,03.1,5=0,045\left(mol\right)\)
PT: \(C_2H_4+Br_2\rightarrow C_2H_4Br_2\)
___0,045__0,045 (mol)
Có: \(V_{C_2H_2}=V_{C_2H_4}\Leftrightarrow n_{C_2H_2}=n_{C_2H_4}=0,045\left(mol\right)\)
PT: \(C_2H_2+2Br_2\rightarrow C_2H_2Br_4\)
___0,045___0,09 (mol)
\(\Rightarrow V_{ddBr_2}=\dfrac{0,09}{1,5}=0,06\left(l\right)=60\left(ml\right)\)
Bạn tham khảo nhé!

Dẫn 2 khí qua dung dịch nước brom chỉ có C 2 H 4 phản ứng
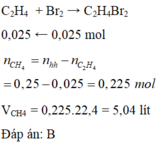

\(n_{hh\left(CH_4,C_2H_4\right)}=\dfrac{5,6}{22,4}=0,25\left(mol\right)\\ n_{Br_2}=\dfrac{4}{160}=0,025\left(mol\right)\\ C_2H_4+Br_2\rightarrow C_2H_4Br_2\\ n_{C_2H_4}=n_{Br_2}=0,025\left(mol\right)\)
Vì số mol tỉ lệ thuận với thể tích, nên ta có:
\(\%n_{C_2H_4}=\dfrac{0,025}{0,25}.100\%=10\%\\ \Rightarrow\%V_{C_2H_4}=10\%;\%V_{CH_4}=100\%-10\%=90\%\)

Chọn D.
Đặt CTTQ của X là CxHy (phân tử có chứa k liên kết π). Ta có:
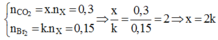
Với x = 2 Þ k = 1: X là C2H4 Þ m = 4,2 (g)
Với x = 4 Þ k = 2: X là C4H6 Þ m = 4,05 (g) Þ giá trị nhỏ nhất.
\(C_2H_4+Br_2\rightarrow C_2H_4Br_2\left(1\right)\\ C_2H_2+2Br_2\rightarrow C_2H_2Br_4\left(2\right)\)
Số mol tỉ lệ thuận thể tích. Ta thấy:
\(V_{C_2H_4}=V_{C_2H_2}\\ \Rightarrow V_{Br_2\left(2\right)}=2.V_{Br_2\left(1\right)}=2.50=100\left(ml\right)\)
Ta chọn C
\(C_2H_4+Br_2\rightarrow C_2H_4Br_2\\PT\Rightarrow n_{Br_2}=n_{C_2H_4}\\ C_2H_2+2Br_2\rightarrow C_2H_2Br_4\\ PT\Rightarrow n_{Br_2}=2n_{C_2H_2}\\ Tacó: n_{C_2H_4}=n_{C_2H_2}\left(doV_{C_2H_4}=V_{C_2H_2}\right)\)
Mà 0,1 lít khí etilen (đktc) làm mất màu tối đa 50 ml dung dịch brom
=> 0,1 lít khí axetilen (đktc) thì có thể làm mất màu tối đa thể tích dung dịch brom trên là 100ml