Đốt cháy hoàn toàn 6,72 lít hỗn hợp khí X gồm một hiđrocacbon CxHy và các bon oxit thì cần dùng vừa đủ 13,44 lít khí O2 thu được 22 g CO2 và 72 g hơi nước tìm công thức phân tử của cxhy và phần trăm theo thể tích của mỗi khí trong hỗn hợp X
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

CxHy:a(mol)
CO:b(mol)
=>a+b\(=\dfrac{6,72}{22,4}\)=0,3(mol)
nCO2=\(\dfrac{22}{44}\)=0,5(mol)
nH2O=\(\dfrac{7,2}{18}\)=0,4(mol)
nO2=\(\dfrac{13,44}{22,4}\)=0,6(mol)
Bảo toàn C: ax + b = 0,5
Bảo toàn H: ay = 0,8
Bảo toàn O: b + 0,6.2 = 0,5.2 + 0,4
=> b = 0,2 (mol)
=> a = 0,1 (mol)
=> x = 3 ; y = 8 => CTPT: C3H8
%VC3H8=\(\dfrac{0,1}{0,3}\).100%=33,33%
%VCO=\(\dfrac{0,2}{0,3}\).100%=66,67%

Số mol 2 chất trong 7,28g M: 
Số mol 2 chất trong 5,2g M: 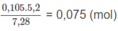
Theo định luật bảo toàn khối lượng:
m C O 2 + m H 2 O = m M + m O 2 = 12.4(g)
Theo đầu bài, số mol C O 2 = số mol H 2 O = n.
44n + 18n = 12,4 ⇒ n = 0,2 (mol)
Các chất trong hỗn hợp có chứa C, H và có thể có O. Chất thứ nhất là C X H Y O Z (a mol) và chất thứ 2 là C X + 2 H Y + 4 O Z (b mol).
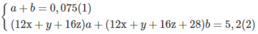
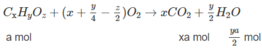
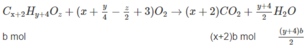
xa + (x + 2)b = 0,2 (3)
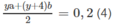
Giải hệ phương trình :
Từ (3) ta có x(a + b) + 2b = 0,200
2b = 0,200 - 0,0750x
b = 0,100 - 0,0375x
0 < b < 0,075 ⇒ 0 < 0,100 - 0,0375x < 0,0750
⇒ 0,660 < X < 2,66
Trong khoảng này có 2 số nguyên là 1 và 2.
Nếu x = 1.
b = 0,100 - 3.75. 10 - 2 = 0,0625
a = 0,0750 - 0,0625 = 0,0125.
Thay giá trị của a và b vào (4) ta có :
0125y + 0,0625(y + 4) = 0,400
⇒ y = 2.
Thay x = 1, y = 2; a = 0,0125, b = 0,0625 vào (2):
(14 + 16z).0,0125 + (42 + 16z).0,0625 = 5,20
⇒ z = 2.
C
H
2
O
2
chiếm: 
C 3 H 6 O 2 chiếm: 100% - 11,1% = 88,9%.
Nếu x = 2 .
b = 0,100 - 0,0375 X 2 = 0,0250
a = 0,0750 - 0,0250 = 0,05
từ đó tìm tiếp, ta được y = 4 và z = 2.
% khối lượng của
C
2
H
4
O
2
: 
% khối lương của C 4 H 8 O 2 : 100% - 57,7% = 42,3%.

a, Ta có: \(n_C=n_{CO_2}=\dfrac{17,6}{44}=0,4\left(mol\right)\)
\(\Rightarrow m_C=0,4.12=4,8\left(g\right)\)
\(\Rightarrow m_H=6-4,8=1,2\left(g\right)\)
b, Ta có: \(n_H=\dfrac{1,2}{1}=1,2\left(mol\right)\)
\(\Rightarrow x:y=0,4:1,2=1:3\)
→ CTPT của A có dạng là (CH3)n.
Mà: MA = 15.2 = 30 (g/mol)
\(\Rightarrow n=\dfrac{30}{12+3}=2\)
Vậy: CTPT của A là C2H6.
c, Ta có: \(n_A=\dfrac{1,5}{30}=0,05\left(mol\right)\)
PT: \(2C_2H_6+7O_2\underrightarrow{t^o}4CO_2+6H_2O\)
Theo PT: \(n_{O_2}=\dfrac{7}{2}n_{C_2H_6}=0,175\left(mol\right)\)
\(\Rightarrow V_{O_2}=0,175.22,4=3,92\left(l\right)\)

Chọn đáp án C
đốt cháy G cần 0 , 16 m o l O 2 → t 0 0 , 14 m o l C O 2 + 0 , 14 m o l H 2 O
n C O 2 = n H 2 O chứng tỏ G là hỗn hợp este no, đơn chức, mạch hở dạng CnH2nO2.
G chứa 2O nên bảo toàn O có 2 n G + 2 n O 2 = 2 n C O 2 + n H 2 O
→ nG = 0,05 mol.
→ n = 0,14 ÷ 0,05 = 2,8
→ G gồm C2H4O2 và C3H6O2.
Sơ đồ chéo hoặc giải hệ có n C 2 H 4 O 2 = 0 , 01 m o l và n C 3 H 6 O 2 = 0 , 04 m o l
→ % s ố m o l e s t e c ó P T K n h ỏ h ơ n = 0 , 01 : 0 , 05 = 20 %
\(\left\{{}\begin{matrix}C_xH_y:a\left(mol\right)\\CO:b\left(mol\right)\end{matrix}\right.=>a+b=\dfrac{6,72}{22,4}=0,3\left(mol\right)\)
\(n_{CO_2}=\dfrac{22}{44}=0,5\left(mol\right)\)
\(n_{H_2O}=\dfrac{7,2}{18}=0,4\left(mol\right)\)
\(n_{O_2}=\dfrac{13,44}{22,4}=0,6\left(mol\right)\)
Bảo toàn C: ax + b = 0,5
Bảo toàn H: ay = 0,8
Bảo toàn O: b + 0,6.2 = 0,5.2 + 0,4
=> b = 0,2 (mol)
=> a = 0,1 (mol)
=> x = 3 ; y = 8 => CTPT: C3H8
\(\left\{{}\begin{matrix}\%V_{C_3H_8}=\dfrac{0,1}{0,3}.100\%=33,33\%\\\%V_{CO}=\dfrac{0,2}{0,3}.100\%=66,67\%\end{matrix}\right.\)
lỗi đề à bn
sao mình nhìn thấy mỗi dấu x