Hòa tan hoàn toàn 8 gam SO3 vào nước thu được 200 ml dung dịch X.
a) Tính nồng độ mol của dung dịch X.
b) Cho 2,8 gam Fe vào 200 ml dung dịch X, khuấy kĩ để phản ứng xảy ra hoàntoàn. Tính thể tích khí H2 thoát ra ở đktc.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a) PTHH: \(SO_3+H_2O\rightarrow H_2SO_4\)
Ta có: \(n_{SO_3}=\dfrac{24}{80}=0,3\left(mol\right)=n_{H_2SO_4}\) \(\Rightarrow m_{ddH_2SO_4}=\dfrac{0,3\cdot98}{20\%}=147\left(g\right)\)
\(\Rightarrow V_{ddH_2SO_4}=\dfrac{147}{1,14}\approx128,95\left(ml\right)\)
b) PTHH: \(Fe+H_2SO_4\rightarrow FeSO_4+H_2\uparrow\)
Theo PTHH: \(n_{Fe}=n_{H_2SO_4}=n_{H_2}=0,3\left(mol\right)=n_{FeSO_4}\)
\(\Rightarrow\left\{{}\begin{matrix}m_{Fe}=0,3\cdot56=16,8\left(g\right)\\V_{H_2}=0,3\cdot24,76=7,428\left(l\right)\\m_{FeSO_4}=0,3\cdot152=45,6\left(g\right)\\m_{H_2}=0,3\cdot2=0,6\left(g\right)\end{matrix}\right.\)
Mặt khác: \(m_{dd}=m_{Fe}+m_{ddH_2SO_4}-m_{H_2}=163,2\left(g\right)\)
\(\Rightarrow C\%_{FeSO_4}=\dfrac{45,6}{163,2}\cdot100\%\approx27,94\%\)

Câu 5. a) \(SO_2+\dfrac{1}{2}O_2-^{t^o,V_2O_5}\rightarrow SO_3\)
\(n_{SO_3}=n_{SO_2}=0,1\left(mol\right)\)
\(SO_3+H_2O\rightarrow H_2SO_4\)
\(n_{H_2SO_4}=n_{SO_3}=0,1\left(mol\right)\)
=> \(CM_{H_2SO_4}=\dfrac{0,1}{0,2}=0,5M\)
b) \(n_{Zn}=0,05\left(mol\right)\)
\(Zn+H_2SO_4\rightarrow ZnSO_4+H_2\)
Lập tỉ lệ : \(\dfrac{0,05}{1}< \dfrac{0,1}{1}\)=> Sau phản ứng H2SO4 dư
=> \(m_{H_2SO_4\left(dư\right)}=\left(0,1-0,05\right).98=4,9\left(g\right)\)
Câu 5 . \(n_{Al_2O_3}=0,2\left(mol\right);n_{H_2SO_4}=0,8\left(mol\right)\)
\(Al_2O_3+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2O\)
Lập tỉ lệ: \(\dfrac{0,2}{1}< \dfrac{0,8}{3}\) => Sau phản ứng H2SO4 dư
\(m_{H_2SO_4}=\left(0,8-0,2.3\right).98=19,6\left(g\right)\)
b)\(n_{Al_2\left(SO_4\right)_3}=n_{Al_2O_3}=0,2\left(mol\right)\)
\(m_{Al_2\left(SO_4\right)_3}=0,2.342=68,4\left(g\right)\)

nFe = 5.6/56 = 0.1 (mol)
nHCl = 0.2*2 = 0.4 (mol)
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
LTL : 0.1/1 < 0.4/2 => HCl dư
mHCl dư = ( 0.4 - 0.2 ) * 36.5 = 7.3 (g)
VH2 = 0.2*22.4 = 4.48 (l)
CM FeCl2 = 0.1/0.2 = 0.5(M)
CM HCl dư = 0.2 / 0.2 = 1(M)

Định hướng tư duy giải
Tư duy đi tắt đòn đầu
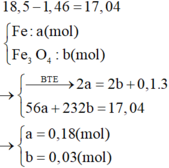
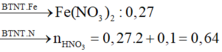
=> [HNO3] = 3,2 (M)

Đáp án : B
nCu = 0,12 mol < ½ nNaOH bđ => Cu2+ chắc chắn bị kết tủa hết
Vì không có khí khi cho NaOH vào => không có NH4NO3
=> có Cu(NO3)2 và HNO3 dư
Giả sử chất rắn gồm : NaNO2 ; NaOH
=> mNaNO2 + mNaOH = 25,28 = 25,28
Bảo toàn Na : nNaNO2 + nNaOH = nNaOH bđ = 0,4 mol
=> nNaOH = 0,08 ; nNaNO2 = 0,32 mol
Bảo toàn nguyên tố : nN(khí) = nHNO3 – nNaNO2 = 0,16 mol = nkhí
=> V = 3,584 lit

Đáp án : B
Số mol Cu 0,12 mol, NaOH 0,4 mol
Sơ đồ phản ứng : C u ⏟ 0 , 12 + H N O 3 ⏟ 0 , 28 à
C u N O 3 2 : 0 , 12 m o l H N O 3 d u : x m o l N O 2 , N O : ? m o l → 0 , 4 m o l + N a O H C u O H 2 : 0 , 12 m o l N a N O 3 : 0 , 24 + x m o l N a O H d u : 0 , 4 - 0 , 24 - x - Tính số mol HNO3 (dư). Phản ứng nhiệt phân NaNO3 . NaOH không bị nhiệt phân.
2NaNO3 à 2NaNO2 + O2 ↑
(mol) (0,24 + x) (0,24 + x)
Khối lượng chất rắn : 69(0,24 + x) + 40(0,4 – 0,24 – x) = 25,28 => x = (2,32 : 29) = 0,08 mol.
Số mol (NO2, NO) = 0,48 – 0,24 – 0,08 = 0,16 mol => V = 22,4 . 0,16 = 3,584 lít
a. \(n_{SO_3}=\dfrac{8}{80}=0,1\left(mol\right)\)
\(C_M=\dfrac{0,1}{200}=0,0005\left(mol\text{/}l\right)\)