Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án D
Nhận thấy ở hai thí nghiệm có lượng kim loại tham gia phản ứng như nhau, lượng HCl sử dụng lớn hơn lượng HCl sử dụng ở thí nghiệm 1 nhưng lượng H2 ở hai thí nghiệm thu được như nhau.
Do đó ở thí nghiệm 2 HCl phản ứng dư, thí nghiệm 1 có HCl phản ứng đủ hoặc dư.
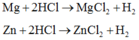
Có
![]()
Quan sát 4 đáp án nhận thấy chỉ có giá trị 0,3 là phù hợp.

a Z n + C u S O 4 → Z n S O 4 + C u Z n + H 2 S O 4 → Z n S O 4 + H 2
(Zn tác dụng với C u S O 4 trước, với H 2 S O 4 (loãng) sau do tính oxi hóa C u 2 + > H + ).
b F e N O 3 2 + A g N O 3 → F e N O 3 3 + A g c C u O + H 2 → t ° C u + H 2 O A l 2 O 3 + H 2 → k h ô n g p h ả n ứ n g d 2 N a + 2 H 2 O → 2 N a O H + H 2 C u S O 4 + 2 N a O H → C u O H 2 + N a 2 S O 4
(Na tác dụng với H 2 O trước, Na không khử được ion C u 2 + trong dung dịch).
e 2 A g N O 3 → t ° 2 A g + 2 N O 2 + O 2 2 K N O 3 → t ° 2 K N O 2 + O 2
→ Có 4 thí nghiệm sau phản ứng thu được kim loại
→ Đáp án C

Đáp án C.
(a) 2NH3 + FeSO4 + 2H2O ® Fe(OH)2¯ + (NH4)2SO4.
(b) 2CO2 + Ba(AlO2)2 + 4H2O ® 2Al(OH)3¯ + Ba(HCO3)2.
(c) Fe(NO3)2 + 3AgNO3 ® Fe(NO3)3 + 3Ag¯.
(d) Na2O + H2O ® 2NaOH sau đó Al2O3 + 2NaOH ® 2NaAlO2 + H2O (vừa đủ).
(e) NaAlO2 dư + HCl + H2O ® NaCl + Al(OH)3¯.
(g) Cu + Fe2(SO4)3 ® CuSO4 + 2FeSO4 (vừa đủ).

Chọn C.
(a) 2NH3 + FeSO4 + 2H2O ® Fe(OH)2¯ + (NH4)2SO4.
(b) 2CO2 + Ba(AlO2)2 + 4H2O ® 2Al(OH)3¯ + Ba(HCO3)2.
(c) Fe(NO3)2 + 3AgNO3 ® Fe(NO3)3 + 3Ag¯.
(d) Na2O + H2O ® 2NaOH sau đó Al2O3 + 2NaOH ® 2NaAlO2 + H2O (vừa đủ).
(e) NaAlO2 dư + HCl + H2O ® NaCl + Al(OH)3¯.
(g) Cu + Fe2(SO4)3 ® CuSO4 + 2FeSO4 (vừa đủ).

Đáp án C
b, c,d,e, g
a: Cu yếu hơn Fe nên không thể đẩy Fe ra được, Fe2(SO4)3 dư nên đồng phải hết
b: AgNO3 dư nên sẽ đẩy sắt ra khỏi dung dịch muối vừa tạo tủa AgCl

Xét TN1:
PTHH: Fe + 2HCl FeCl2 + H2 (1)
Giả sử: Fe phản ứng hết Chất rắn là FeCl2
*Xét TN2:
PTHH: Mg + 2HCl MgCl2 + H2 (2)
Fe + 2HCl FeCl2 + H2 (3)
Ta thấy: Ngoài a gam Fe như thí nghiệm 1 cộng với b gam Mg mà chỉ giải phóng: < 0,024 (mol)
Chứng tỏ: Trong TN1: Fe dư, HCl hết
Ta có: nHCl (TN 1) = nHCl(TN 2) = 2nH = 2 . 0,02 = 0,04(mol)
TN1:
nFe(pư) = nFeCl= nHCl = . 0,04 = 0,02(mol)
=> mFe(dư) = 3,1 – 0,02.127 = 0,56 (gam)
mFe(pư) = 0,02 . 56 = 1,12(gam)
=> mFe = a = 0,56 + 1,12 = 1,68(gam)
*TN2:
Áp dụng ĐLBTKL:
a + b = 3,34 + 0,02.2 - 0,04.36,5 = 1,92 (g)
Mà a = 1,68g b = 1,92 - 1,68 = 0,24 (g)
PTPƯ 1:
\(Mg+2HCl->MgCl_2+H_2\)
0,1 0,2 0,1
\(Zn+2HCl->ZnCl_2+H_2\)
0,1 0,2 0,1
Gọi x, y là số mol của H2
Ta có hệ pt:
\(\left\{{}\begin{matrix}24x+65y=8,9\\22,4x+22,4y=4.48\end{matrix}\right.\)
\(=>x=y=0,1\left(mol\right)\)
\(M=\dfrac{n}{V}=\dfrac{0,2}{2}=0,1\left(M\right)\)
Pư 2 làm tg tự nha <3