Đốt cháy hoàn toàn 6,72 lít hỗn khí gas gồm CH4 và C4H10 trong không khí thu được CO2 và hơi nước.Biết trong hỗn hợp có V-CH4 : V-C4H10=1:2
a)Viết PTHH
b)Tính: V không khí cần dùng và V-CO2 sinh ra.Thể tích các khí được đo ở điều kiện tiêu chuẩn
Mọi người giải hộ em chứ hôm sau nữa em phải nộp rồi

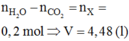
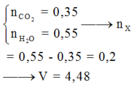
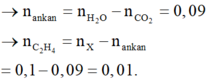
a) CH4 + 2O2 --to--> CO2 +2H2O
2C4H10 + 13O2 --to--> 8CO2 + 10H2O
b) \(\left\{{}\begin{matrix}n_{CH_4}+n_{C_4H_{10}}=\dfrac{6,72}{22,4}=0,3\\\dfrac{n_{CH_4}}{n_{C_4H_{10}}}=\dfrac{1}{2}\end{matrix}\right.\)
=> \(\left\{{}\begin{matrix}n_{CH_4}=0,1\\n_{C_4H_{10}}=0,2\end{matrix}\right.\)
PTHH: CH4 + 2O2 --to--> CO2 +2H2O
_____0,1--->0,2--------->0,1
2C4H10 + 13O2 --to--> 8CO2 + 10H2O
__0,2---->1,3------->0,8
=> VO2 = (0,2+1,3).22,4 = 33,6 (l)
=> Vkk = 33,6.5 = 168 (l)
VCO2 = (0,1+0,8).22,4 = 20,16 (l)
Bạn ơi cho mình hỏi là trong PTHH2 vì sao O2 lại là 1,3 mol vậy mình tính ra lại bằng 2,6 mol cơ