GUEST : OXIT AXIT PHẢN ỨNG VỚI DUNG DỊCH BAZO
Đề : Với khối lượng m (g) P2O5, cho phản ứng hoàn toàn với 507 ml dung dịch NaOH 2M. Sau phản ứng thu được dung dịch A ( không chứa H3PO4) . Cô cạn dung dịch A thu được 3m (g) rắn khan. Tính giá trị của m
PT : 2GP

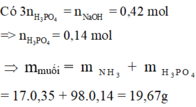
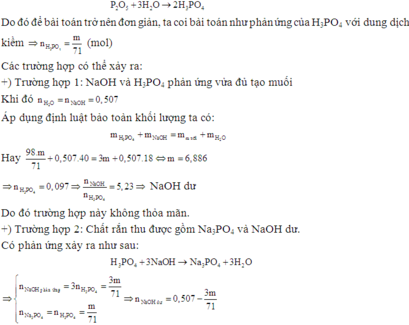
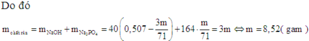
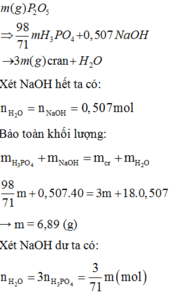
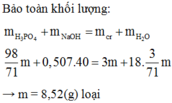

Ta có: $n_{P_2O_5}=\frac{m}{141}(mol);n_{NaOH}=1,014(mol)$
$\Rightarrow n_{H_3PO_4}=\frac{m}{71}\Rightarrow n_{H_2O}=\frac{3m}{71}$
Bảo toàn khối lượng ta có:
\(\dfrac{98}{71}m+40,56=3m+\dfrac{3m}{71}.18\Rightarrow m=17,04\left(g\right)\)
\(n_{NaOH} = 0,507.2 = 1,014(mol)\)
Nếu rắn khan chứa :
\(\left\{{}\begin{matrix}Na^+:1,014\left(mol\right)\\PO_4^{3-}:x\left(mol\right)\\HPO_4^{2-}:y\left(mol\right)\end{matrix}\right.\)
Bảo toàn P : 0,5(x + y).142 = m
Muối : \(m_{muối}\) = 1,014.23 + 95x + 96y = 3m
Bảo toàn điện tích: 3x + 2y = 1,014
Suy ra: y =-0,432 <0 => Loại
\(\left\{{}\begin{matrix}Na^+:1,014\left(mol\right)\\PO_4^{3-}:a\left(mol\right)\\OH^-:b\left(mol\right)\end{matrix}\right.\)
Bảo toàn điện tích : 3a + b = 1,014
\(m_A\) = 1,014.23 + 95a + 17b = 3m
Bảo toàn P : 0,5a.142 = m
Suy ra: a = 0,24 ; b = 0,294; m = 17,04(gam)