Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Các kim loại như Na,K,Ca,Ba ,... đều phản ứng với nước sinh ra hidro những không dùng để điều chế vì các kim loại này có tính khử mạnh,phản ứng mãnh liệt với nước, gây nổ mạnh nguy hiểm cho người thực hiện thí nghiệm
Vì Hiđro hòa tan trong nhiều kim loại nếu bị rò rỉ thì có thể có những ảnh hưởng xấu đến các kim loại như tính giòn, dẫn đến rạn nứt và gây nổ
_________________________
Không đúng thì nhắn mình nha bạn :))

Đáp án D
Các phương trình phản ứng điều chế các khí:
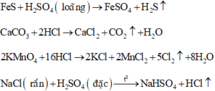
Khí X được thu bằng phương pháp đẩy nước, do đó X phải không tan hoặc ít tan trong nước
Vậy X không thể là HCl vì HCl tan nhiều trong nước

a.\(n_{HCl}=\dfrac{10,95}{36,5}=0,3mol\)
\(2Al+6HCl\rightarrow2AlCl_3+3H_2\)
0,3 0,15 ( mol )
\(V_{H_2}=0,15.22,4=3,36l\)
b.\(n_{Fe_2O_3}=\dfrac{12}{160}=0,075mol\)
\(Fe_2O_3+3H_2\rightarrow\left(t^o\right)2Fe+3H_2O\)
\(\dfrac{0,075}{1}\) > \(\dfrac{0,15}{3}\) ( mol )
0,15 0,1 ( mol )
\(m_{Fe}=0,1.56=5,6g\)
\(2Al+6HCl\rightarrow2AlCl_3+3H_2\uparrow\)
1 : 6 : 2 : 3 (mol)
0,05 : 0,3 : 0,1 : 0,15 (mol)
\(n_{HCl}=\dfrac{m}{M}=\dfrac{10,95}{36,5}=0,3\left(mol\right)\)
a. \(V_{H_2\left(đktc\right)}=n.24,79=0,15.24,79=3,7185\left(l\right)\)
b. \(Fe_2O_3+3H_2\rightarrow^{t^0}2Fe+3H_2O\)
1 : 3 : 2 : 3 (mol)
0,075 : 0,15 (mol)
\(n_{Fe_2O_3}=\dfrac{m}{M}=\dfrac{12}{160}=0,075\left(mol\right)\)
-Chuyển thành tỉ lệ: \(\dfrac{0,075}{1}>\dfrac{0,15}{3}=0,05\)
\(\Rightarrow\)H2 phản ứng hết còn Fe2O3 dư.
\(Fe_2O_3+3H_2\rightarrow^{t^0}2Fe+3H_2O\)
1 : 3 : 2 : 3 (mol)
0,05 : 0,15 : 0,1 : 0,15 (mol)
\(\Rightarrow m_{Fe}=n.M=0,1.56=5,6\left(g\right)\)

Câu trả lời đúng là C.
PT: 2Al + 3H2SO4 → Al2(SO4)3 + 3H2
Từ phản ứng này ⇒ có thể điều chế khí H2
Khí H2 nhẹ hơn không khí nên úp ngược ống nghiệm sẽ thu được khí H2

Do Na2SO3 còn tính khử nên không dùng axit nitric, nếu không sẽ tạo ra khí khác
axit sunfuric H2S rất yếu; axit clohiđic: sợ lẫn khí HCl
Vậy nên dùng H2SO4 là tốt nhất

![]()
Để điều chế 0,05 mol H 2 thì:
n Z n = n M g = 0,05 mol mà M M g < M Z n
⇒ Dùng Mg sẽ cần khối lượng nhỏ hơn
n H C l = 2 . n H 2 = 0,05 . 2 = 0,1 mol ⇒ m H C l = 0,1 . 36,5 = 3,65 g
n H 2 S O 4 = n H 2 = 0,05 mol ⇒ m H 2 S O 4 = 0,05 .98 = 4,9g
⇒ Dùng axit HCl sẽ cần khối lượng nhỏ hơn
Nên với những chất đã cho muốn dùng với khối lượng nhỏ nhất để điều chế H 2 ta dùng Mg và axit HCl

\(n_{H_2}=\dfrac{13,44}{22,4}=0,6mol\)
\(Mg+2HCl\rightarrow MgCl_2+H_2\)
\(Zn+2HCl\rightarrow ZnCl_2+H_2\)
Có \(\Sigma n_{H_2}=n_{Mg}+n_{Zn}=0,6\)
Mà \(n_{Mg}=n_{Zn}\Rightarrow n_{Mg}=n_{Zn}=0,3mol\)
\(m_{Mg}=0,3\cdot24=7,2g\)
\(m_{Zn}=0,3\cdot65=19,5g\)
\(\Sigma n_{HCl}=2n_{Mg}+2n_{Zn}=2\cdot0,3+2\cdot0,3=1,2mol\)
\(\Rightarrow m_{HCl}=1,2\cdot36,5=43,8g\)

giả sử 2 kim loại cùng 1 khối lượng là a , ta có
\(2Al+6HCl->2AlCl_3+3H_2\)
(mol) \(\frac{a}{27}\) \(\frac{a}{18}\)
\(Fe+2HCl->FeCl_2+H_2\)
(mol) \(\frac{a}{56}\) \(\frac{a}{56}\)
vì \(\frac{a}{56}< \frac{a}{18}\) => cùng 1 khối lượng như nhau , Al cho thể tích khí hidro nhiều hơn Fe
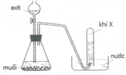
+) Điều chế hidro trong PTN bằng cách lấy kim loại đứng trước H tác dụng với dd axit như HCl hay H2SO4 (loãng), sau đó thu khí hidro bằng cách đẩy không khí hoặc đẩy nước
+) Người ta không dùng các kim loại như Na, K, Ba, Ca hay Pb và Sn vì những kim loại này có giá thành đắt và một số lý do khác như: Pb không tan trong HCl và tan trong H2SO4 không tạo hidro, còn các kim loại kiềm và kiềm thổ p/ứ mãnh liệt với nước trong dd gây nguy hiểm khi điều chế ...