Đốt cháy hoàn toàn 122 lít (đktc) hiđrô với lượng khí oxi dư. Hỏi thu được thể tích nước ở trạng thái lỏng là bao nhiêu?
hãy giúp mình
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(n_{H_2}=\dfrac{112}{22,4}=5\left(mol\right)\)
Bảo toàn nguyên tố H : \(n_{H_2}.2=n_{H_2O}.2\)
=> nH2O =5(mol)
=> m H2O = 5.18= 90(g)

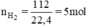
Phương trình phản ứng tổng hợp nước:
2H2 + O2 → 2H2O.
Theo pt: nH2O = nH2 = 5mol.
mH2O= 5.18 = 90g.
Khối lượng riêng của nước là 1g/ml thể tích nước lỏng thu được là 90ml.

\(a) 2H_2 + O_2 \xrightarrow{t^o} 2H_2O\\ n_{H_2O} = \dfrac{1,8}{18} = 0,1(mol)\\ n_{H_2} = n_{H_2O} = 0,1 \Rightarrow V_{H_2} = 0,1.22,4 = 2,24(lít)\\ V_{O_2} = \dfrac{1}{2}V_{H_2} = 1,12(lít)\\ b) n_{H_2O} = n_{H_2} = \dfrac{112}{22,4} = 5(mol)\\ \Rightarrow m_{H_2O} = 5.18 = 90(gam)\)
\(2H_2+O_2\rightarrow2H_2O\uparrow\)
2 1 2
\(\frac{305}{56}\)---------->
\(n_{H_2}=\frac{122}{22,4}=\frac{305}{56}\left(mol\right)\)
=> \(n_{H_2O}=n_{H_2}=\frac{305}{56}\left(mol\right)\)
=> \(V_{H_2O}=\frac{305}{56}.22,4=122\left(l\right)\)
bạn ơi chưa đúng rồi . đáp án bài này là 50 ml