Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a) K2O + H2O → 2KOH (phản ứng hóa hợp).
b) 2Al(OH)3 \(\underrightarrow{t^o}\) Al2O3 + 3H2O (phản ứng phân hủy)
c) Fe2O3 + 3H2 \(\underrightarrow{t^o}\) 2Fe + 3H2O ( phản ứng oxi hóa khử)
d) Zn + CuSO4 → ZnSO4 + Cu (phản ứng thế)
Em xem lại các bài học sau để nắm rõ định nghĩa về các loại phản ứng nhé
https://hoc24.vn/ly-thuyet/bai-25-su-oxi-hoa-phan-ung-hoa-hop-ung-dung-cua-oxi.434
https://hoc24.vn/ly-thuyet/bai-27-dieu-che-khi-oxi-phan-ung-phan-huy.436
https://hoc24.vn/ly-thuyet/bai-32-phan-ung-oxi-hoa-khu.441
https://hoc24.vn/ly-thuyet/bai-33-dieu-che-hidro-phan-ung-the.442

\(2Cu+O_2\rightarrow\left(t^o\right)2CuO\) ( hóa hợp )
\(CuO+H_2SO_4\rightarrow CuSO_4+H_2O\) ( thế )
5/\(2H_2+O_2\rightarrow\left(t^o\right)2H_2O\) ( hóa hợp )
\(SO_3+H_2O\rightarrow H_2SO_4\) ( hóa hợp )
\(Zn+H_2SO_4\rightarrow ZnSO_4+H_2\) ( thế )
\(Fe_3O_4+4H_2\rightarrow\left(t^o\right)3Fe+4H_2O\) ( thế )
\(Fe+2HCl\rightarrow FeCl_2+H_2\) ( thế )
6/\(2KClO_3\rightarrow\left(t^o,MnO_2\right)2KCl+3O_2\) ( phân hủy )
\(2H_2+O_2\rightarrow\left(t^o\right)2H_2O\) ( hóa hợp )
\(2H_2O\rightarrow\left(đp\right)2H_2+O_2\) ( phân hủy )
\(3Fe+2O_2\rightarrow\left(t^o\right)Fe_3O_4\) ( hóa hợp )
7/\(4Na+O_2\rightarrow\left(t^o\right)2Na_2O\) ( hóa hợp )
\(Na_2O+H_2O\rightarrow NaOH\) ( hóa hợp )
8/\(2H_2+O_2\rightarrow\left(t^o\right)2H_2O\) ( hóa hợp )
\(SO_3+H_2O\rightarrow H_2SO_4\) ( hóa hợp )
\(Zn+H_2SO_4\rightarrow ZnSO_4+H_2\)

a, SO3 + H2O ---> H2SO4
H2SO4 + Zn ---> ZnSO4 + H2
3H2 + Fe2O3 --to--> 2Fe + 3H2O
3Fe + 2O2 --to--> Fe3O4
b, 2H2O --đp--> 2H2 + O2
O2 + 2Cu --to--> 2CuO
CuO + CO --to--> Cu + CO2
Cu ---> H2 :)? Cu là kim loại yếu nên ko thể tác dụng với axit có giải phóng khí H2
c, Zn + H2SO4 ---> ZnSO4 + H2
H2 + ZnO --to--> Zn + H2O
2H2O --đp--> 2H2 + O2
O2 -> NaOH khí oxi ko thể tạo ra bazơ được

a) $4P + 5O_2 \xrightarrow{t^o} 2P_2O_5$
b) $Mg + Cl_2 \xrightarrow{t^o} MgCl_2$
c) $2Na + 2H_2O \to 2NaOH + H_2$
d) $C + O_2 \xrightarrow{t^o} CO_2$
e) $C_xH_y + (x + \dfrac{y}{4})O_2 \xrightarrow{t^o} xCO_2 + \dfrac{y}{2}H_2O$
f) $2Al + Fe_2O_3 \xrightarrow{t^o} Al_2O_3 + 2Fe$
g) $2Al + 3H_2SO_4 \to Al_2(SO_4)_3 + 3H_2$
i) $Fe_xO_y + yCO \xrightarrow{t^o} xFe + yCO_2$
k) $Fe_2O_3 + 6HCl \to 2FeCl_3 +3 H_2O$
l) $3Fe + 2O_2 \xrightarrow{t^o} Fe_3O_4$

a, 2Al + 3CuO -> Al2O3 + 3Cu
2 : 3 -> 1 : 3
b, BaCl2 + 2AgNO3 -> 2AgCl + Ba(NO3)2
1 : 2 -> 2 : 1
c, 2NaOH + H2SO4 -> Na2SO4 + 2H2O
2 : 1 -> 1 : 2

2Cu + O2 -> 2CuO
2Al(OH)3 + 3H2SO4 -> Al2(SO4)3 + 6H2O
2Fe + 3Cl2 -> 2FeCl3
CnH2n + 3n/2O2 -> nCO2 + nH2O

\(Zn+2HCl->ZnCl_2+H_2\)
\(C+H_2O->CO+H_2\)
=> 2 phản ứng oxh-khử

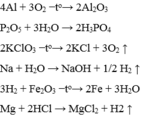
\(a.2Al+3CuO-^{t^o}>Al_2O_3+3Cu\)
\(b.2Na+2H_2O->2NaOH+H_2\)
\(c.Cu+2H_2SO_{4_{dn}}->CuSO_4+SO_2+2H_2O\)