Hòa tan hoàn toàn 7,7 gam hỗn hợp gồm Mg và Zn vào dung dịch HNO3 loãng, thu được dung dịch X và V lít khí N2. Cho dung dịch NaOH ( dư) vào X và đun nóng, tạo thành 2,9 gam kết tủa và 0,28 lít khí mùi khai thoát ra. Các thể tích được đo ở điều kiện tiêu chuẩn. Tính phần trăm khối lượng của Zn trong hỗn hợp ban đầu và giá trị của V là
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án D
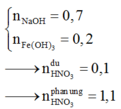
Theo giả thiết, ta có :

Quy đổi hỗn hợp X thành Fe và O. Theo bảo toàn khối lượng, bảo toàn electron, bảo toàn điện tích cho dung dịch Z và bảo toàn nguyên tố N, Fe, ta có :
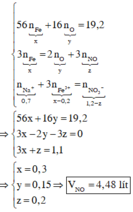

Đáp án C
nHNO3 bđ = 1,5 ; nNO2 = 0,2 (mol)
Khi thêm nước lọc vào T và thu được lượng kết tủa max thì phần dung dịch nước lọc chỉ chứa NaNO3.
Bảo toàn N => nNaNO3 = nHNO3 – nNO2 = 1,3 (mol)
=> nNaOH = 1,3 => Vdd NaOH = 1,3 (lít)
Đặt a, b là số mol Fe3O4 và CuO
mhh = 232a + 80b = 29,2 (1)
Có: nCO2 = nBaCO3 = 0,05 (mol) = nO( trong oxit pư)
Bảo toàn e cả quá trình: nNO2 = nFe3O4 + 2nO (mất đi khi + CO)
=> nFe3O4 = nNO2 - 2nO (mất đi khi + CO) = 0,2 – 2.0,05 = 0,1 (mol)
=> %mFe3O4 = [0,1. 232: 29,2].100% = 79,45%

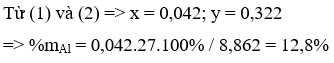


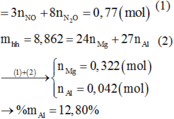

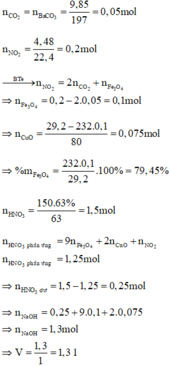

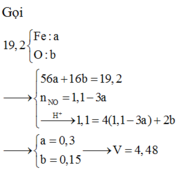
X + NaOH dư -> khí mùi khai là NH3 => Trong X có muối NH4NO3
NH4NO3 + NaOH --> NaNO3 + NH3 + H2O
nNH3 = 0,28:22,4=0,0125 mol = nNH4NO3
ZnNO3 tan hết trong NaOH dư, 2,9 gam kết tủa là Mg(OH)2
nMg(OH)2 = 0,05 mol , BTNT Mg => nMg = 0,05 mol
<=> mZn = 7,7-0,05.24 = 6,5 gam <=> nZn = 6,5:65 = 0,1 mol
=> %mZn = \(\dfrac{6,5}{7,7}.100\%\)= 84,5%
Mg0 ---> Mg+2 + 2e 2N+5 + 10e --> N20
0,05 ---> 0,1 10x <----x
Zn0 ---> Mg+2 + 2e N+5 + 8e --> N-3
0,1 ---> 0,2 0,1<----0,0125
Áp dụng ĐLBT eletron => nN2 = (0,1 + 0,2 - 0,1):10 = 0,02 mol
=> V = 0,02.22,4 = 0,448 lít