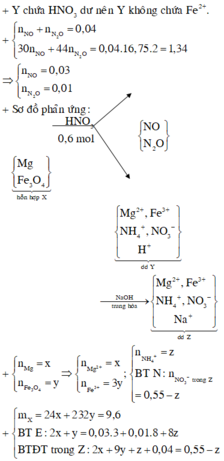
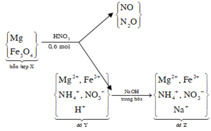
Cho 9,6 gam hỗn hợp X gồm Mg và Fe3O4 vào 300 ml dung dịch HNO3 2M, thu được dung dịch Y và 0,896 lít (đktc) hỗn hợp N2O và NO có tỉ khối so với hiđro là 16,75. Trung hòa Y cần dùng 40 ml NaOH 1M thu được dung dịch Z, cô cạn Z thu được m gam muối khan. Biết rằng phản ứng xảy ra hoàn toàn và khi cô cạn muối không bị nhiệt phân. Giá trị m là
A. 42,26
B. 19,76
C. 28,46
D. 72,45

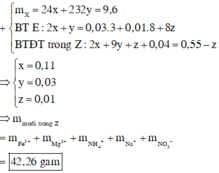
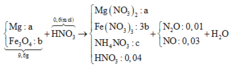





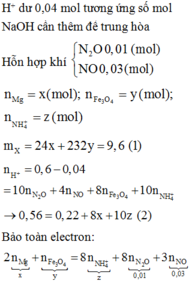
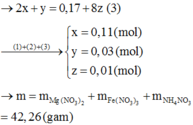
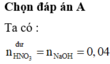
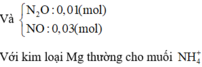
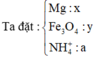
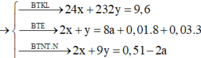
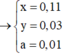
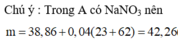
Đáp án A
Từ nhỗn hợp khí và tỉ khối hơi
⇒ nN2O = 0,01 và nNO = 0,03.
nNaOH trung hòa = nHNO3 dư = 0,04 mol
⇒ Sơ đồ tóm tắt ta có:
PT theo m hỗn hợp:
24a + 232b = 9,6 (1)
PT bảo toàn e:
2a + b – 8c = 0,01×8 + 0,03×3 = 0,17 (2)
PT theo ∑nHNO3:
Û 8b + 10c = 0,34 (3)
+ Giải hệ ta có:
a = 0,11 || b = 0,03 || c = 0,01.
⇒ Sau trung hòa dung dịch chứa
⇒ mMuối = 42,26 gam