Điện phân 150 ml dung dịch AgNO3 1M với điện cực trơ trong t giờ, cường độ dòng điện không đổi 2,68A (hiệu suất quá trình điện phân là 100%), thu được chất rắn X, dung dịch Y và khí Z. Cho 12,6 gam Fe vào Y, sau khi các phản ứng kết thúc thu được 14,5 gam hỗn hợp kim loại và khí NO (sản phẩm khử duy nhất của N+5). Giá trị của t là
A. 0,8.
B. 0,3.
C. 1,0.
D. 1,2.


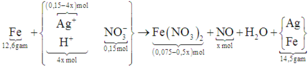

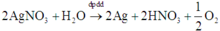
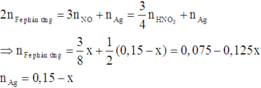
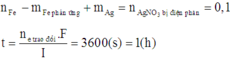
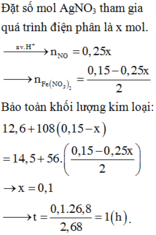

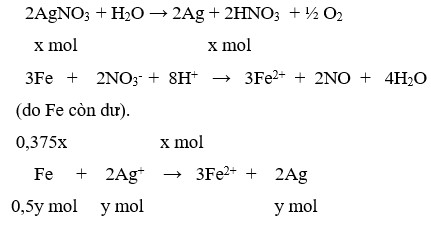
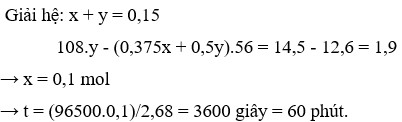
Đáp án C
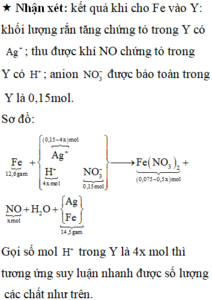
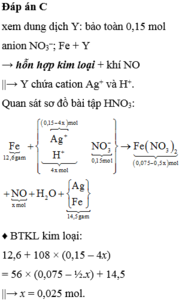
Nhận xét được lượng chất rắn > bột Fe nên sau phản ứng điện phân thì AgNO3 còn dư và chất rắn này
cũng có thể gồm Fe dư ( nếu không dư thì trong quá trình tính toán số mol nó = 0 thôi ).
Cả quá trình: điện phân: 2AgNO3 + H2O → 2Ag + 2HNO3 + ½.O2↑ .
Sau đó: 3Fe + 8HNO3 → 3Fe(NO3)2 + 2NO↑ + 4.H2O. || Fe + 2AgNO3 → Fe(NO3)2 + 2Ag↓.
Quan trọng tiếp theo là chọn ẩn sao cho tính toán nhanh:
gọi số mol AgNO3 bị điện phân là x mol, số mol sắt bị hoà tan là y mol thì ta có:
Khối lượng chất rắn: 14,5 = ( 0,225 - y) × 56 + (0,15 - x ) × 108 → 108x + 56y = 14,3 gam.
Số mol sắt phản ứng: y = (0,15 - x ) ÷ 2 + 3x ÷ 8 → x ÷ 8 + y = 0,075 mol.
Vậy thời gian điện phân t = 96500 × 0,1 ÷ 2,68 = 3600 s = 1h → chọn C.