Hỗn hợp X gồm Ba, BaO, Na, Na2O và K. Cho m gam hỗn hợp X vào nước dư thu được 3,136 lít H2 (đktc); dung dịch Y chứa 7,2 gam NaOH; 0,93m gam Ba(OH)2 và 0,044m gam KOH. Hấp thụ 7,7952 lít CO2 (đktc) vào dung dịch Y thu được a gam kết tủa. Giá trị của a gần nhất với giá trị nào sau đây?
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án A
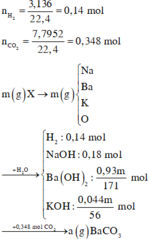
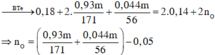
m = 23 . 0 , 18 + 137 . 0 , 93 m 171 + 39 . 0 , 44 m 56 + 16 n o
=> m - 23 . 0 , 18 + 137 . 0 , 93 m 171 + 39 . 0 , 044 56 + 16 0 , 93 m 171 + 0 , 044 56 - 0 , 05
=> m = 25,5 g

Giá trị a gần nhất với giá trị 25,5

Đáp án : C
Nếu ta đốt cháy X tạo hỗn hợp T toàn oxit thì lượng mol nguyên tố kim loiaj không đổi
=> nH2 = nO pứ = 0,14 mol => moxit = mX + mO pứ = m + 2,24 (g)
Y : nNaOH = 0,18 => nNa2O = 0,09 mol
,nBa(OH)2 = nBaO = 31m/5700 ; nK2O = ½ nKOH = 5,5m/14000
=> mT = mBaO + mNa2O + mK2O
=> m = 25,5g
=> nOH = 0,4774 mol
,nCO2 = 0,348 mol
=> nCO3 = nOH – nCO2 = 0,1294 mol < nBa = 0,1387 mol
=> nBaCO3 = 0,1294
=>a = 25,49g

Coi như hỗn hợp X chỉ gồm Na, K, Ba, O
Cho X vào nước thì 3 kim loại phản ứng sinh ra khí H2, còn O tác dụng với H2 để tạo ra nước theo tỷ lệ 1Oxi+1H2
\(\Rightarrow\) \(n_{H_2}=\frac{1}{2}n_{Na}+\frac{1}{2}n_K+n_{Ba}-n_O=0,14\left(mol\right)\)
Có \(n_{Na}=n_{NaOH}=0,18\left(mol\right)\)
\(n_K=n_{KOH}=\frac{0,044m}{56};n_{Ba}=n_{Ba\left(OH\right)_2}=\frac{0,93m}{171}\left(mol\right)\)
\(\Rightarrow n_O=\frac{1}{2}n_{Na}+\frac{1}{2}n_K+n_{Ba}-n_{H_2}=0,09+\frac{0,022m}{56}+\frac{0,465m}{171}\)
Lại có phương trình tổng khối lượng hỗn hợp X:
\(m_X=m=m_{Na}+m_K+m_{Ba}+m_O\\ =0,18.23+\frac{0,044m}{56}.39+\frac{0,93m}{171}.137+m_O\)
Thay số mol Oxi tính được (theo m) ở trên vào ta được phương trình 1 ẩn m
giải ra được \(m\approx25,5\)

Gọi số mol NaOH là a (mol)
\(n_{Ba\left(OH\right)_2}=\dfrac{20,52}{171}=0,12\left(mol\right)\); \(n_{H_2}=\dfrac{1,12}{22,4}=0,05\left(mol\right)\)
Ta có sơ đồ:
\(21,9\left(g\right)X\left\{{}\begin{matrix}Na\\Ba\\Na_2O\\BaO\end{matrix}\right.+H_2O\rightarrow\left\{{}\begin{matrix}Ba\left(OH\right)_2:0,12\left(mol\right)\\NaOH:a\left(mol\right)\end{matrix}\right.+H_2:0,05\left(mol\right)\)
Bảo toàn H: \(n_{H_2O}=\dfrac{0,12.2+a+0,05.2}{2}=0,17+0,5a\left(mol\right)\)
Bảo toàn khối lượng:
\(m_X+m_{H_2O}=m_{Ba\left(OH\right)_2}+m_{NaOH}+m_{H_2O}\)
=> \(21,9+18\left(0,17+0,5a\right)=20,52+40a+0,05.2\)
=> a = 0,14 (mol)
=> m = 0,14.40 = 5,6 (g)

Qui đổi hỗn hợp X thành Na (x mol), Ba (y mol), O (z mol)
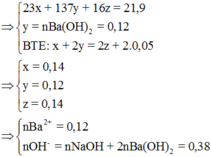
nCO32- = nOH- - nCO2 = 0,38 – 0,3 = 0,08 mà nBa2+ = 0,12 ⇒ mBaCO3↓ = 0,08.197 = 15,76g ⇒ Chọn A.




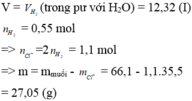
Đáp án A
1/ Quy X về Ba, Na, K và O => nNa = nNaOH = 0,18 mol; nBa = nBa(OH)2 = 0,93m/171 mol
nK = nKOH = 0,044m/56 mol. Bảo toàn electron: 2nBa + nK + nNa = 2nO + 2nH2
=> nO = (2.0,93m/171 + 0,044m/56 - 0,1)/2 ||=> mX = mBa + mK + mNa + mO
= 137.0,93m/171 + 39.0,044m/56 + 0,18.23 + 16.(2.0,93m/171 + 0,044m/56 - 0,1)/2 = m
=> m = 25,5 (g) => nBa(OH)2 = 0,1387 mol; nKOH = 0,02 mol
=> nOH = 0,4774 mol => nOH/nCO2 = 1,37 => tạo CO32- và HCO3-
Ta có CT sau:
nCO32- = nOH- - nCO2 = 0,1294 mol nBaCO3 = nCO32- = 0,1294
||=> a = 0,1294.197 = 25,4918(g)