Dung dịch X gồm 0,1 mol H+ ; a mol Al3+ ; b mol NO3- ; 0,02 mol SO42-. Cho 120 ml dung dịch Y gồm KOH 1,2M và Ba(OH)2 0,1M vào dung dịch X sau khi kết thúc phản ứng thu được 3,732g kết tủa . Giá trị của a,b lần lượt là :
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Bảo toàn điện tích cho dung dịch X
2nSO4(2-) = 0,1.2+0,2=0,4(mol)
=> nSO4(2-) = 0,2(mol)
Bảo toàn điện tích cho dung dịch Y
nOH- = nNa+ + 2nBa2+ = 0,3 +2.0,1=0,5(mol)
OH- + H+ -> H2O
0,2......0,2 (mol)
Ba2+ + SO4 2- -> BaSO4
0,1.........0,1 .........0,1 (mol)
Fe2+ + 2OH- -> Fe(OH)2
0,1.........0,2 .......0,1 (mol)
mkết tủa = 0,1.233 + 0,1.90=32,3(g)
BTĐT X : 2.0,1+ 0,2=2.nSO4 2-
=> nSO4 2-=0.2
BTĐT Y : 0,3 + 0,1.2=nOH-
=>nOH-=0,5
H+ + OH- ---> H2O
0,2-----0,2
Ba2+ SO4 2- ----> BaSO4
0,1--------------------0,1
Fe2+ + 2OH------> Fe(0h)2
0,1-------------------0,1
mkết tủa = 0,1.233+ 0,1.90=32,3

Đáp án C
nBa2+ = 0,012 < 0,02 = nSO42- ⇒ nBaSO4 = nBa2+ = 0,012
m↓ = mBaSO4 + mAl(OH)3 = 3,732g
⇒ nAl(OH)3 = 0,012
H+ + OH- → H2O
0,1 → 0,1 (mol)
Al3+ + 3OH- → Al(OH)3
z → 3z z (mol)
Al(OH)3 + OH- → AlO2- + H2O
Z – 0,12 → z – 0,12 (mol)
nOH- ban đầu = 0,168 = nH+ + 3nAl3+ + nAlO2- = 0,1 + 3z + z – 0,012
⇒ z = 0,02
Bảo toàn điện tích: 3z + 0,1 = t + 0,02.2 ⇒ t =0,12

\(n_{OH^-}=0.12\cdot\left(1.2+0.1\cdot2\right)=0.168\left(mol\right)\)
Trong dung dịch X, bảo toàn điện tích :
\(0.1+3z=t+0.02\cdot2\)
\(\Rightarrow t-3z=0.06\left(1\right)\)
Khi cho dung dịch X và dung dịch Y phản ứng thì :
\(H^++OH^-\rightarrow H_2O\)
\(0.1.......0.1\)
\(Ba^{2+}+SO_4^{2-}\rightarrow BaSO_4\)
\(0.012.....0.012............0.012\)
=> SO42- dư
\(m_{BaSO_4}=0.012\cdot233=2.796\left(g\right)\)
\(\Rightarrow n_{Al\left(OH\right)_3}=\dfrac{3.732-2.796}{78}=0.012\left(mol\right)\)
\(Al^{3+}+3OH^-\rightarrow Al\left(OH\right)_3\)
\(n_{OH^-}\)phản ứng với \(Al\left(OH\right)_3\)\(=0.168-0.1=0.068\left(mol\right)< 3n_{Al\left(OH\right)_3}\)
\(\Rightarrow n_{Al^{3+}}=\dfrac{n_{Al\left(OH\right)_3}+n_{OH^-}}{4}=\dfrac{0.012+0.068}{4}=0.02\left(mol\right)\)
\(\Rightarrow z=0.02\)
\(\left(1\right):t=0.12\)

$n_{OH^-} = 0,12.1,2 + 0,12.0,1.2 = 0,168(mol)$
$n_{Ba^{2+}} = 0,012 < n_{SO_4^{2-}} = 0,02$ nên $SO_4^{2-}$ dư
$n_{BaSO_4} = n_{Ba^{2+}} = 0,012(mol)$
$\Rightarrow n_{Al(OH)_3} = \dfrac{3,732 - 0,012.233}{78} = 0,012(mol)$
Al3+ + 3OH- → Al(OH)3
z............3z...............z................(mol)
Al(OH)3 + OH- → AlO2- + 2H2O
z-0,012.....z-0,012.................................(mol)
Suy ra: 3z - (z - 0,012) = 0,168
Suy ra: z = 0,078
Bảo toàn điện tích, t = 0,294

Bảo toàn điện tích : 0,1 + 3z = t + 0,02.2 → t-3z = 0,06
Nhận thấy kết tủa gồm BaSO4 : 0,012 mol, Al(OH)3: 0,012 mol
Ta có 3×nkết tủa + nH+ = 0,136 mol < nOH- = 0,168 mol → Xảy ra trường hợp hòa tan kết tủa
H+ + OH- → H2O
0,1 ------> 0,1
Al3+ + 3OH- → Al(OH)3
0,012---0,036 ------> 0,012
Al3+ + 4OH- → Al(OH)4-
0,008----> 0,032
Vậy z= 0,012 + 0,008 =0,02 → t= 0,12. Đáp án B

Đáp án B
BTĐT cho dung dịch X ta có : 0,1 + 3z = t + 0,04.
![]()
![]()
![]()
![]()
![]()
![]()
nOH- phản ứng với Al3+ = 0,168 – 0,1 = 0,068mol < 3nAl(OH)3
=> nAl(OH)3= 4nAl3+ - nOH- => nAl3+ = (nAl(OH)3 + nOH-) : 4 = 0,02mol = z
![]()
= 0,12 mol


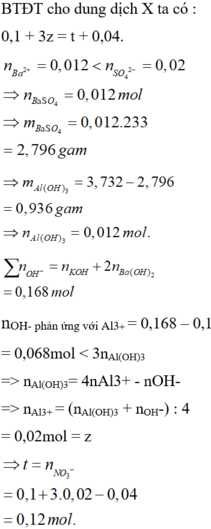
Đáp án : A
Bảo toàn điện tích : nH+ + 3nAl3+ = nNO3- + 2nSO4 => 3a – b = -0,06
, nOH = nKOH + 2nBa(OH)2 = 0,168 mol ; nBa2+ = 0,012 mol
, mkết tủa = mBaSO4 + mAl(OH)3 => nAl(OH)3 = 0,012 mol < 1/3( nOH – nH+)
=> Có hiện tượng kết tủa tan 1 phần => nAl(OH)3 = 4nAl3+ - (nOH- - nH+)
=> nAl3+ = a = 0,02 => b = 0,12